公共卫生学术热点追踪
《自然》重磅:吃太咸真的会傻!康奈尔科学家发现,高盐饮食会导致阿尔茨海默病相关蛋白过度磷酸化,损害大脑认知功能
来,大声回答我一个问题,世卫组织(WHO)推荐的食盐日摄入量是多少?
5g。
那么,中国人均食盐日摄入量是多少?
10. 6g。
好吧祖国地大物博,这是14亿人均的,如果你在山东,那就是12.5g。
翻看着今天更新的《自然》,不由得开始为自己担心。吃了so多盐,还没感觉长了啥见识,不会就这么变傻了吧?
这项研究来自纽约威尔-康奈尔医学院科学团队,研究者们发现,高食盐摄入竟然会促进小鼠大脑中的tau蛋白磷酸化,进而导致认知障碍[1]!要知道这个tau蛋白可是和阿尔茨海默病等不少会导致痴呆的疾病有关,原来还真是“咸傻”的?

这个团队说来也是老熟人了,我们去年曾经报道过发表在《自然·神经科学》上的一篇前期研究。
没看过不要紧,一起来复习一下:高食盐摄入会激活小鼠小肠内的TH17细胞,导致血液中白介素17(IL-17)水平增加,进而减少了大脑中内皮细胞产生的一氧化氮(NO),导致血管调节失衡,大脑血流量,最终小鼠发生了认知障碍[2]。
那缺血了怎么就傻了呢?血液循环嘛,送氧气送营养的生命线啊,一般科学家也就认为,血流量降低减少了相关大脑区域的氧和葡萄糖供给[3,4],所以认知水平跟不上了。

图源 | pixabay
但是研究者们实验做着做着,感觉这个事儿有点不对。
实验里小鼠确实脑血流量减少了[2],而血管相关认知障碍的人类患者也是有这样的症状[5],但是单单血流减少这一个因素,应该是不足以就这么让大脑罢工的[6]。
肯定还有别的原因,接着找吧。
研究者们反向思考了这个问题。在许多与认知障碍有关的脑血管疾病中,都曾发现tau蛋白沉积的踪迹[7,8],而另一方面,tau蛋白的超磷酸化以及其不溶物的沉积又是阿尔茨海默病(AD)以及其他tau蛋白病的主要病理表现。会不会说,盐和认知的中间,也是隔着一个tau蛋白呢?

图源 | pixabay
和之前的研究一样,研究者们也是给小鼠设计了一套超重口味菜谱,鼠粮里NaCl的占比达到了4%-8%,是正常鼠粮的8-16倍。
果不出所料,吃咸了的小鼠脑子里那叫一个乱套,随着实验的继续,大脑皮层和海马体中磷酸化tau蛋白(p-tau)水平不断增加,不过总tau蛋白的水平没有变。
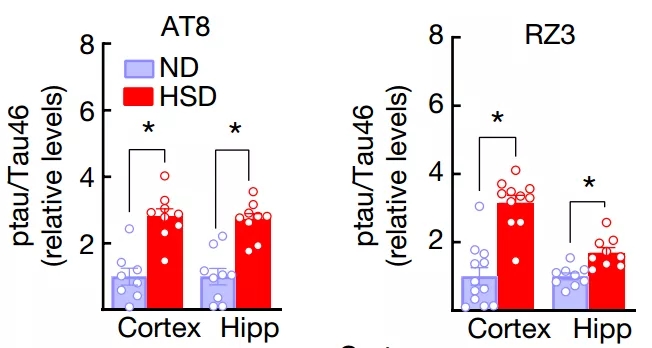
高盐饮食之后p-tau水平骤增
当然,咱不能光拿p-tau说事儿,毕竟最终搞破坏的还是那些不溶性tau蛋白[9]。而高盐饮食12周后,小鼠脑内的不溶性tau蛋白水平也有了很大的增加。
此时它们是真的傻了,很难识别新的物体,走迷宫也慢了许多。
当研究者敲除小鼠的基因,让它们无法产生tau蛋白,又或者给小鼠注射tau蛋白抗体,此时就算吃着高盐饮食,小鼠也不会变傻了,可见高盐导致的认知障碍确实是由tau蛋白介导的。
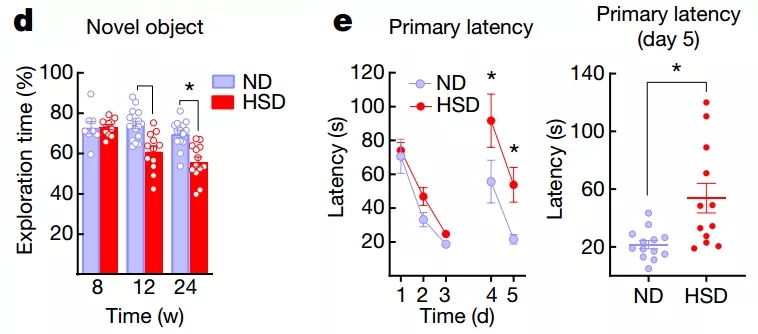
小鼠认知水平直线下降
那么高盐和tau蛋白又是怎么扯上关系的呢?
其实此前研究的发现是完全走对了路线的,只是距离终点还差几步,关键依旧是落在了NO上。
话说这个tau蛋白,它的磷酸化是要靠细胞周期依赖性蛋白激酶5(CDK5)的[9],CDK5呢,又受到p35的调控[10,11]。
坏事儿就在高盐饮食导致NO减少,直接导致钙激活酶(calpains)活性增加,把p35切割成了p25,这就一下造成了CDK5的异常激活,进而导致tau蛋白过度磷酸化[10,11]。
看,一步走错,步步皆错。
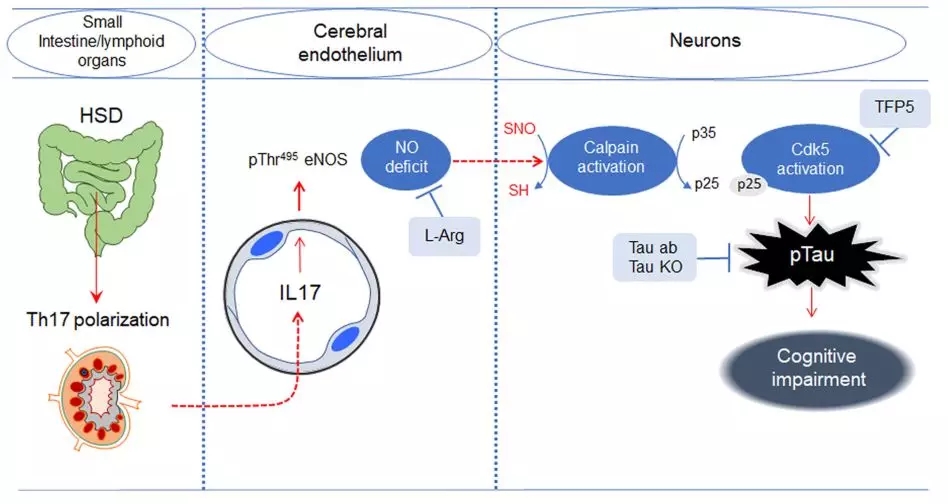
根据研究者们的计算,实验中小鼠的摄入量大概与目前报告的人类最高盐摄入量一致(12.5-20g/天)[12],在这个水平下,食盐和tau病理以及血管功能的关联尚属首次发现。血管相关疾病和痴呆症总是有剪不断理还乱的关联,或许盐就是其中至关重要的一环。
至于到底怎么挽救“咸死”的脑瓜,这得科学家们继续埋头实验室,而我们能做的,估计也只有先吃淡点儿了…………
(来源:奇点网)
参考文献:
[1] https://www.nature.com/articles/s41586-019-1688-z
[2] Faraco, G. et al. Dietary salt promotes neurovascular and cognitive dysfunction through a gut-initiated TH17 response. Nat. Neurosci. 21, 240–249 (2018).
[3] Iadecola, C. The pathobiology of vascular dementia. Neuron 80, 844–866 (2013).
[4] Sweeney, M. D. et al. Vascular dysfunction—the disregarded partner of Alzheimer’s disease. Alzheimers Dement. 15, 158–167 (2019).
[5] Shi, Y. et al. Cerebral blood flow in small vessel disease: a systematic review and metaanalysis. J. Cereb. Blood Flow Metab. 36, 1653–1667 (2016).
[6] Marshall, R. S. et al. Recovery of brain function during induced cerebral hypoperfusion.Brain 124, 1208–1217 (2001).
[7] Nation, D. A. et al. Pulse pressure in relation to tau-mediated neurodegeneration, cerebral amyloidosis, and progression to dementia in very old adults. JAMA Neurol. 72, 546–553 (2015).
[8] Kim, H. J. et al. Assessment of extent and role of tau in subcortical vascular cognitive impairment using 18F-AV1451 positron emission tomography imaging. JAMA Neurol. 75, 999–1007 (2018).
[9] Wang, Y. & Mandelkow, E. Tau in physiology and pathology. Nat. Rev. Neurosci. 17, 5–21 (2016).
[10] Lee, M. S. et al. Neurotoxicity induces cleavage of p35 to p25 by calpain. Nature 405, 360–364 (2000).
[11] Patrick, G. N. et al. Conversion of p35 to p25 deregulates Cdk5 activity and promotes neurodegeneration. Nature 402, 615–622 (1999).
[12] Powles, J. et al. Global, regional and national sodium intakes in 1990 and 2010: a systematic analysis of 24 h urinary sodium excretion and dietary surveys worldwide. BMJ Open 3, e003733 (2013).
链接:https://mp.weixin.qq.com/s/JIqp5FM_pxo5CkINBQNJBQ
