公共卫生学术热点追踪
Dev Cell | 朱源团队发现在关键发育时期治疗可预防儿童视神经胶质瘤的发生
肿瘤、癌症是困扰人民群众健康的一大问题。随着老龄化社会的来临,肿瘤癌症的发病率快速增加。癌症的发生,与遗传因素(Hereditary)、环境因素(Environmental)和细胞分裂时DNA复制错误(Replication errors)成高度相关,这被学界公认为癌症的EHR (Environmental-Hereditary-Replication) 模型[1,2]。尤其是在干细胞的分裂复制过程中,DNA复制错误是随时发生的,随着一代代干细胞的分裂复制,我们的体内将会累积大量的DNA复制错误,其中一些有害的DNA错误 (在原癌基因和抗癌基因) 可能导致体内的细胞开始不受控制地分裂,因此形成肿瘤,甚至导致癌症[1,2]。同理,流行病调查结果显示,在老年群体中更容易看到肿瘤发病率随着年龄平均寿命的增加而越加增高。然而,流行的EHR模型并不能解释儿童肿瘤的发生成因。目前推测,儿童肿瘤形成并不是像成人肿瘤那种——累积大量的DNA复制错误,而是在特定的,发育的关键时期在某些重要的干细胞/前体细胞内发生突变,导致肿瘤细胞的快速分裂而形成。这个模型的关建是发育关键时期某些重要的干细胞/前体细胞在成长过程中逐渐消失,不在成人中导致肿瘤的威胁。然而这些只在发育时期特定存在的干细胞/前体细胞还有待探查。
脑肿瘤是儿童最常发生的实体肿瘤,其中绝大多数脑肿瘤属于儿童期低级别胶质瘤(PLGG)[3,4]。大约10%-15%的儿童期低级别胶质瘤是由家族性癌症易感综合征(familial cancer predisposition syndrome)引起,即儿童1型神经纤维瘤病(NF1)[5]。该遗传基因缺陷可导致视神经胶质瘤和脑肿瘤的发生。约20% NF1基因突变的儿童会引发视神经胶质瘤,因而,临床称之为NF1相关视神经胶质瘤 (NF1-associated optic pathway glioma, NF1-OPG)。针对该肿瘤,目前有多种治疗方案,包括手术、化疗等,但多是在晚期才进行治疗,仍无有效的疗法可预防或缓解肿瘤带来神经性损害,例如:视力损伤、失明。因此,该肿瘤及当前治疗方法严重影响了患儿的生活质量[5]。
2021年8月23日,美国国家儿童医院和乔治.华盛顿大学朱源教授团队(Emmanuelle S. Jecrois, 郑望, Miriam Bornhorst博士为共同第一作者)在Developmental Cell杂志在线发表文章 Treatment during a developmental window prevents NF1-associated optic pathway glioma by targeting Erk-dependent migrating glial progenitors(关键发育期针对性治疗ERK通路依赖性的迁移胶质前体细胞,可预防儿童1型神经纤维瘤病(NF1)相关视神经胶质瘤的发生)[6] 。该研究揭示了关键时期Erk通路依赖的迁移胶质前体细胞在视神经胶质瘤发生中的作用。该文章对于儿童期低级别胶质瘤 (pediatric low-grade glioma,PLGG) 的特异性治疗带来了概念突破性的进展,该发现阐明了在肿瘤早期针对性治疗,可预防肿瘤细胞产生的病变及副作用(视力损伤等)。

绝大多数的儿童期低级别胶质瘤 (PLGG) 被认为是由于RAS-ERK/MAPK单一信号通路发生改变而引起的肿瘤,其中关键的一个调控分子是NF1[3,5]。NF1蛋白可控制细胞的增值,NF1蛋白通过调控下游的MEK/ERK信号通路,调控正常细胞的增值、存活和分化[5]。当MEK/ERK信号通路过度激活时,该通路通常会导致肿瘤产生。早期,Gutmann实验室认为Nf1缺失导致第三(III)脑室内的神经干细胞过度增殖,最终产生NF1-OPG [7]。但是值得注意的是,第三脑室内的神经干细胞本身并不直接迁移到视神经,而是由神经干细胞产生的胶质前体细胞迁移到视神经,然后发育。因此,NF1-OPG不太可能是由神经干细胞直接形成。
朱源教授研究团队发现[6],在视神经早期发育阶段,存在着两群胶质前体细胞,即原位产生的星形胶质前体细胞(Local astrocyte precursor cells),主要表达Pax2蛋白,和由大脑产生迁移而来的胶质前体细胞(brain-derived migrating glial progenitors),主要表达BLBP蛋白。那么到底哪群细胞能引发Nf1-OPG呢?朱源教授研究团队通过比较不同的Nf1突变老鼠模型,发现视神经中本身的Pax2细胞并不依赖Nf1/MEK/Erk信号通路,在Pax2细胞上特异性敲除Nf1,并不能产生OPG。相反的是,这些从大脑迁移过来的BLBP+前体细胞在胎鼠新生期迁移至视神经,并高度依赖于Nf1/MEK/Erk信号通路,在这群细胞中敲除Nf1蛋白,最终产生Nf1-OPG。
进一步的研究发现,当Nf1基因缺失时,这群由第三脑室来源的BLBP+前体细胞会异常增殖,在下丘脑室旁区会产生大量的放射状胶质细胞(hypothalamic mantle zone radial glia)。随后这些异常增生的胶质细胞迁移至新生的视神经,它们及子代胶质细胞将进一步增殖,从而产生肿瘤。随着肿瘤的进一步发展,小鼠的视网膜神经节细胞 (retina ganglion cells,RGC) 逐渐丧失,从而导致视力损伤,甚至失明。另外作者也注意到Nf1基因缺失会导致第三III脑室内的神经干细胞减少,与过去的研究结果是相反的,对此作者正在做进一步的研究。
随后,该研究作者又在不同的转基因小鼠模型上进行验证。MADM转基因小鼠依赖于Cre蛋白引起的基因同源重组,使基因敲除细胞远小于传统的转基因小鼠品系,并且通过不同的颜色标记野生型和基因敲除细胞(正常比例为1:1),因而能提供更高分辨率的在体细胞水平研究[8]。在Nf1-MADM转基因小鼠上,他们成功复现了Nf1基因敲除引起的III脑室来源的BLBP+前体细胞异常增殖。接下来,作者在实验小鼠上联合敲除Nf1和下游信号通路的Mek1/2蛋白,三敲小鼠成功阻止了Nf1相关视神经胶质瘤的产生。并且,三敲小鼠也避免了Nf1-OPG导致的相关的视网膜神经节细胞丧失,视力并未发生损伤。
最后,作者设计了一个临床相关的治疗方案,就是通过母鼠喂奶将MEK抑制剂药物传递给新生小鼠(MEKi-in-milk)[9]。该研究发现,在小鼠出生后的三个星期内,通过母鼠喂奶传递的药物可以有效地抑制小鼠上该肿瘤的发生。该论文指出,在此关键期给予低剂量的MEK/Erk抑制剂,有效的抑制了BLBP+迁移前体细胞,从而避免了NF1-OPG的形成。并且,在停药两个月后,NF1基因敲除小鼠也不会再发生肿瘤。作者解释到,针对Erk的抑制程度,是和抑制肿瘤的发生高度相关,该临床前实验可极大改善实验对象健康和生存率(图1)。
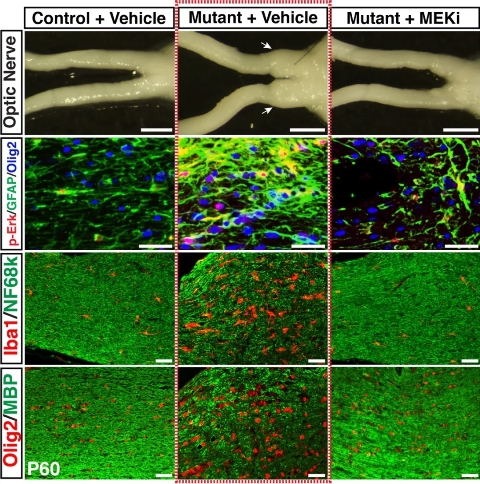
图1:短暂低剂量的MEK抑制剂可有效抑制NF1-OPG的发生。中间加框部分为对照治疗,NF1-OPG发生在视神经近视交叉处,右侧为MEK抑制剂治疗组,未见肿瘤特性的细胞,未形成肿瘤。
朱源教授认为,我们的最新发现为研究NF1-OPG的发生提供了一种新的成因解释(图2),并可能为今后儿童的NF1相关视神经胶质瘤设计以化疗为基础的预防治疗提供参考。他表示,针对该信号通路的治疗,同时也能为多种发育障碍和儿童期肿瘤带来治疗希望,例如RAS遗传综合症(RASopathies)。
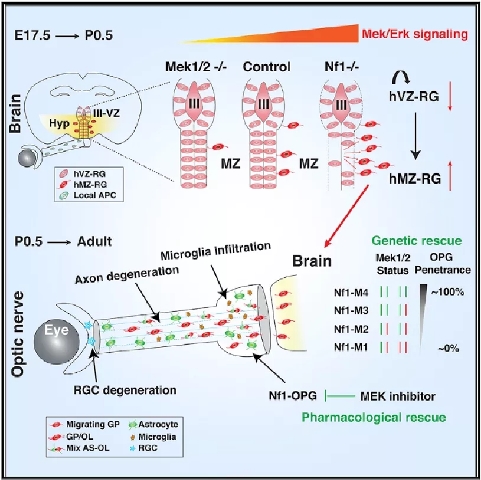
图2:NF1-OPG发生机理及治疗机制。
目前,MEK/ERK抑制剂以投入初期临床实验,甚至在一月龄大小婴儿上亦可以使用。因此,该研究可为NF1基因缺陷病人的化疗提供准临床治疗思路。该治疗方案不仅针对NF1相关视神经胶质瘤,并可为儿童1型神经纤维瘤病的治疗带来希望。
(来源:BioArt)
参考文献:
[1] Song, M., et al. (2018). Cancer prevention: Molecular and epidemiologic consensus. Science 361, 1317-1318.
[2] Tomasetti, C., et al. (2017). Stem cell divisions, somatic mutations, cancer etiology, and cancer prevention. Science 355, 1330-1334.
[3] Jones, D.T.W., et al. (2018). Pediatric low-grade gliomas: next biologically driven steps. Neuro-Oncology 20, 160–173.
[4] Ryall, S., et al. (2020). Integrated molecular and clinical analysis of 1,000 pediatric low-grade gliomas. Cancer Cell 37, 569–583.e5.
[5] Packer, R.J., et al. (2020). Implications of new understandings of gliomas in children and adults with NF1: report of a consensus conference. Neuro-Oncology 22, 773–784.
[6] Jecrois et al., 2021, Developmental Cell 56, 1–15.
[7] Lee, D.Y., et al. (2012). Innate neural stem cell heterogeneity determines the patterning of glioma formation in children. Cancer Cell 22, 131–138.
[8] Liu, C., et al. (2011). Mosaic analysis with double markers reveals tumor cell of origin in glioma. Cell 146, 209–221.
[9] Wang, Y., et al. (2012). ERK inhibition rescues defects in fate specification of Nf1-deficient neural progenitors and brain abnormalities. Cell 150, 816–830.
链接:https://mp.weixin.qq.com/s/fr4QX4Y_sxQ2QGNYcEA2Pw
