公共卫生学术热点追踪
Nat Med:科学家首次发现超级细菌会劫持肺部神经,抑制免疫系统功能
自抗生素被发明以来,细菌们为了存活,产生出强大的耐药性。
它们不仅通过变异衍生出“超级细菌”,更可怕的是,科学家们发现这些超级细菌竟然还会“劫持”我们的神经细胞,“控制”免疫系统,从而使它更安全地存活在人体内。
近期,哈佛医学院的研究人员证实,机体感染超级细菌出现肺炎时,肺部感觉疼痛的神经元捕捉到这一信息会释放神经肽来抑制肺部的免疫力。而仅通过阻断神经肽的释放,便会使小鼠抗感染的能力增强10倍,让95%的感染致命肺炎的小鼠“不治自愈”,研究成果发表在近期 Nature Medicine中。
对此,本研究通讯作者、哈佛医学院微生物与免疫生物学系助理教授Isaac Chiu表示,靶向神经系统可能是一个提高免疫力的方法,随着耐药性细菌出现,有必要使用非抗生素方法来治疗难治性细菌感染。
一听到肺炎,大家可能并不陌生。但在抗生素飞速发展的今天,很多人可能觉得肺炎不过就是区区小病,吃几粒药,输瓶液过两天就好了。可事实上,世界卫生组织指出,在全球引起发病和造成死亡的疾病中,肺炎位列为第三,在儿童和老年人群中,肺炎仍是致死的主要原因之一。
而这其中,头号杀手就要数金黄色葡萄球菌了,近年来,它越来越不受抗生素的管控,表现出多重耐药性,还衍生出了毒性超强的“超级细菌”—耐甲氧西林金黄色葡萄球菌(MRSA),也就万古霉素对它还有点用,可它对肺炎的有效率也就只有66.7%。也就是说,对于很大一部分患者,抗生素这条路越来越行不通了。
那还有其他的什么办法么?
哈佛医学院研究团队注意到这样一个现象,当气道、肺部有炎症的时候,肺部感觉疼痛的神经元会把信号传递给大脑,大脑就会命令我们的气道收缩或咳嗽,将气道内有害物质排出去,这是肺内感觉神经元对机体的一种保护作用。
同时,他们早期研究发现,当神经细胞检测到细菌入侵时产生的疼痛,介导了过敏性哮喘的发生。因此,研究人员怀疑感觉疼痛的神经细胞可能会通过增强免疫反应起到对人体的保护作用。
想到这里,研究人员立即进行了验证,使用毒素靶向小鼠肺内痛觉感受器使其减少,随后向气管内接种致死剂量的耐甲氧西林金黄色葡萄球菌(MRSA),结果却出乎意料,与对照组相比,痛觉感受器减少的小鼠95%都存活了下来,核心体温更稳定,肺内细菌更少,而对照组80%的小鼠死于肺炎。
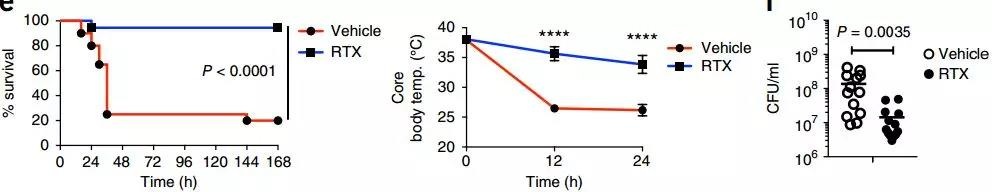
肺部感染MRSA后,痛觉感受器减少的小鼠存活率、核心体温、肺内细菌群落总数显著减少
(Vehicle:对照组;RTX:痛觉感受器减少组)
搞了半天,肺内感受痛觉的神经细胞竟然在抗超级细菌上拖了后腿,那对其他细菌是否也有同样的效果呢?研究人员在对小鼠给予致死剂量的肺炎链球菌、肺炎克雷伯菌和铜绿假单胞菌后发现,小鼠痛觉感受器缺失对生存率、核心体温等并无影响。
为什么会出现这样一个结果呢?哈佛医学院细胞生物学教授Stephen Liberles解释说,“有一种可能性是因为不同种类的神经元可能对免疫系统可能有不同的作用,但更有可能的原因是,某些病原体可能已经进化到可以劫持并利用免疫抑制途径来帮助它们存活下来。”
随后,研究人员便开始探索痛觉感受器是如何干扰小鼠免疫系统的。
通过对小鼠肺部金葡菌感染后的肺部炎症分析后发现,相比于普通小鼠,痛觉感受器被抑制的小鼠在肺部感染12h和24h后,免疫细胞大量涌入肺内,中性粒细胞和主要存在肺内的γδT免疫细胞大量增加,促炎细胞因子水平迅速升高且很快消退,可以在感染早期阶段引发快速的免疫反应,清除细菌的能力提高了10倍。
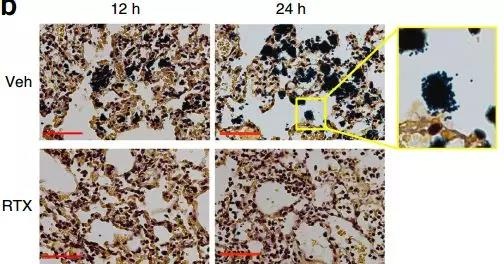
感染后12h和24h,痛觉感受器减少的小鼠细菌菌落减少(Veh:对照组 RTX:痛觉感受器减少组)
同时,他们还发现了其中的具体机制。在实验过程中研究人员观察到,金葡菌感染小鼠的痛觉感受器会释放一种名为CGRP的神经肽,这种神经肽的释放可以干扰肺部召唤中性粒细胞、细胞因子和γδT细胞的能力。阻断CGRP神经肽的产生时,同样可以显著改善肺炎小鼠的存活率以及维持核心体温。
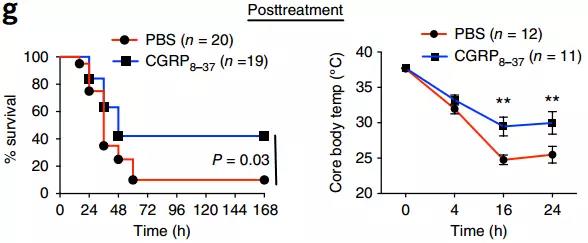
阻断CGRP神经肽的产生,小鼠存活率和核心体温维持改善
因此,痛觉感受器在调节免疫系统和细菌性肺炎中起着非常重要的作用,靶向神经免疫信号可能是增强人体抵抗肺炎入侵的有效途径。
正如Isaac Chiu博士所说,“神经系统和免疫系统的传统界限越来越模糊,我们的研究强调了这两个系统相互交流来调节彼此功能的想法,当我们在这条道路继续前行时,免疫学家应更多考虑神经系统的作用,神经学家应更多地考虑免疫系统。”
(来源:奇点网)
原文出处:Baral P, Umans BD, Li L, Wallrapp A, Bist M, Kirschbaum T, Wei Y, Zhou Y, Kuchroo VK, Burkett PR, Yipp BG, Liberles SD, Chiu IM. Nociceptor sensory neurons suppress neutrophil and γδ T cell responses in bacterial lung infections and lethal pneumonia. Nat Med. 2018 Mar 5. doi: 10.1038/nm.4501. [Epub ahead of print]
链接:https://www.nature.com/articles/nm.4501
