公共卫生学术热点追踪
《自然》子刊:“吃货”血小板!科学家发现血小板能吞噬血液中的流感病毒,促进NET释放,或为流感增加心梗风险原因
去年一部《工作细胞》火遍了网络,其中的血小板更是萌翻了无数人。然而其实,这些血小板还是一个个吃货。当然,血小板们吃的可不是各种美食,而是入侵我们身体的病原体。
近日,Nature Communications上马赛诸塞大学医学院的Milka Koupenova和Jane Freedman等的一项研究显示,血小板可以吞噬并消化进入血液的流感病毒,并进一步激活中性粒细胞,让其释放胞外陷阱(NET),捕杀流感病毒[1]。
不过这也增加了血栓形成的可能性,或许是流感感染后易发心梗的原因之一。
流感本身不可怕,常常可以不治自愈,但期间出现的各种并发症就不是那么好对付了。流感引起的肺炎、病毒性心肌炎、病毒性脑炎等等并发症,正是流感死亡的主要原因[2]。
除此以外,流感还能大幅增加心肌梗死的风险。去年NEJM上的一项研究[3]就显示,感染流感后的头7天,心梗发病率足足有平时的6倍多[3]。而流感疫苗对心梗的预防效果,甚至能与他汀类和降压药等心梗二级预防相媲美[4]。
心梗自然与血小板异常激活形成血栓有关[5],而血小板的功能也并不只局限于形成血栓止血,在对抗病原体的免疫过程中,血小板同样有着不可小觑的作用。在严重的流感感染中,血小板的数量就跟患者的死亡率负相关[6]。
血小板真容 (来自宾夕法尼亚大学)
会不会正是流感中血小板发挥免疫功能的同时,促进了血栓的形成,增加了心梗的发病率?对此,研究人员展开了研究。
研究人员收集了患有甲型H1N1、甲型H3N2或乙型流感的共18位患者的血液样本,对其中的血小板进行了观察。在镜下,这些血小板形态各异,从无伪足的小血小板到围在白细胞周围的卫星状血小板应有尽有。
更为关键的是,其中的一些血小板上还连有大团的DNA,而DNA上还带着中性粒细胞的标志物CD66b和髓过氧化物酶。这可能正是中性粒细胞释放的胞外陷阱!
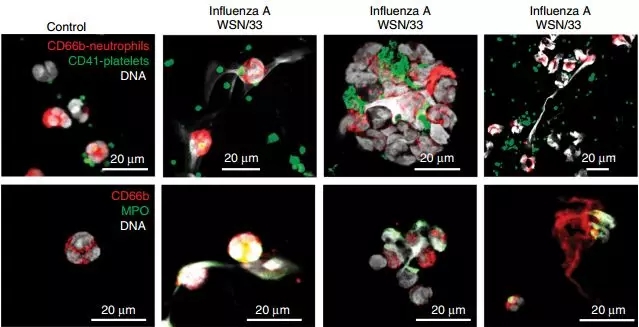
流感患者血液中的血小板与NET缠在一起
中性粒细胞胞外陷阱(NET)可以说是中性粒细胞的终极大招了。中性粒细胞牺牲自己,把各种抗菌物质连在自己的DNA上,像一张网一样撒出去[7],捕获并杀死病原体的同时,也把炎症限制在局部[8]。不过同时,NET也是血栓形成的一个危险因素[9]。
在体外试验中,研究人员证实了这一过程。健康人的血液在与流感病毒共同孵育后,中性粒细胞NET的释放增加了40%,并与血小板聚集在一起。此前被发现的NET大多是粘附在各种组织上的中性粒细胞释放的,血液中游离的中性粒细胞释放NET,这还是首次被观察到。
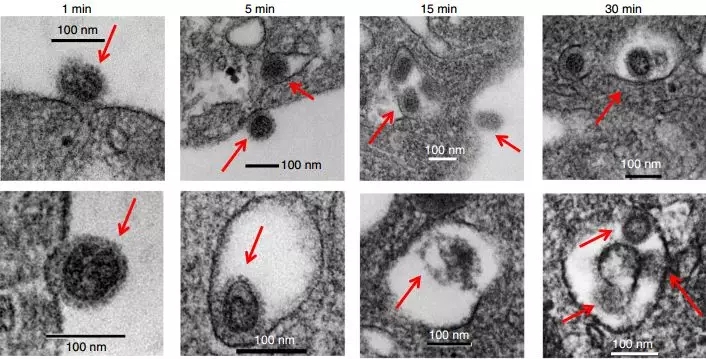
血小板吞噬并消耗流感病毒
除了外面连有NET,这些流感患者血液中的血小板里面也不同寻常,可以检测到流感病毒的RNA和核蛋白。莫非有些流感病毒被血小板吃了?血小板也有吞噬病原体的功能?
研究人员在体外把来自健康人的血小板和流感病毒放到了一起。1分钟后,流感病毒就附着到了血小板表面。5分钟时,就有部分病毒被吞噬到了血小板里面。而到了15分钟,血小板对病毒的吞噬仍在继续,先前吞噬进去的病毒也逐渐被消化了。
由于血小板没有细胞核,病毒无法在其中复制,只能慢慢等待死亡。血小板的吞噬作用也把血液中的病毒聚集在了一起,增大了体积,便于吞噬细胞将其吞噬清除。研究人员猜测,血液中数量众多的无核血小板,可能在减少病毒繁殖,增强抗病毒免疫中有着重要作用。
血小板可能是血管内抵抗病原体的第一道防线!
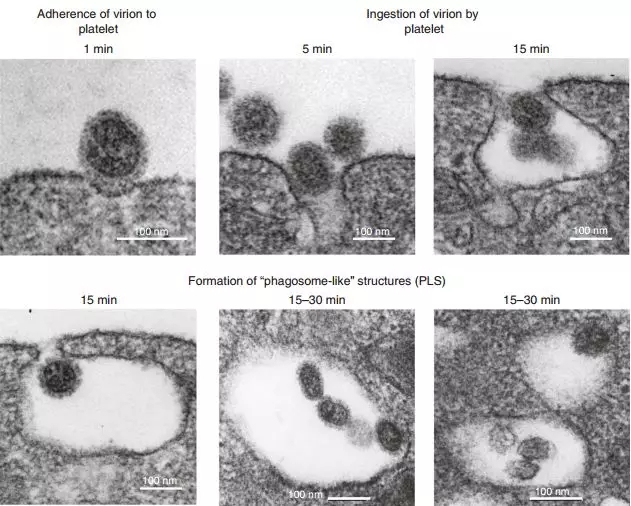
流感病毒被血小板吞噬的过程
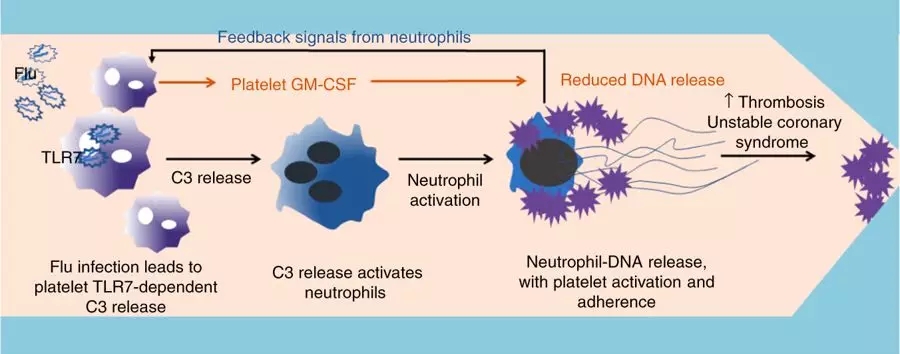
进一步研究发现,流感病毒被血小板消化后,其中的病毒RNA激活了血小板中相应的受体TLR7,引起了血小板释放补体C3和粒细胞-巨噬细胞集落刺激因子(GM-CSF)。
GM-CSF可以延缓中性粒细胞死亡,并启动其上识别病原体的toll样受体[10]。而补体C3,则被发现促进了NET的释放。
流感病毒被血小板吞噬后,激活了血小板,进而通过补体C3促进了中性粒细胞释放胞外陷阱。而NET的释放,在对抗病毒感染的同时,却也增加了血栓形成的风险,可能是流感后心梗风险升高的原因。
论文作者Milka Koupenova在她的博客中写道:“在过去的150年里,血小板被认为是参与止血、血管完整性和血栓形成的主要血液成分。然而,在过去的几十年里,血小板生物学家已经开始重视起血小板在感染期间对宿主免疫的贡献。尽管如此,仍有许多工作要做,才能使这些无核的小英雄们的真正辉煌大白于世。”
(来源:奇点网)
参考文献:
1. Koupenova M, Corkrey H A, Vitseva O, et al. The role of platelets in mediating a response to human influenza infection[J]. Nature communications, 2019, 10(1): 1780.
2. Sellers S A, Hagan R S, Hayden F G, et al. The hidden burden of influenza: A review of the extra‐pulmonary complications of influenza infection[J]. Influenza and other respiratory viruses, 2017, 11(5): 372-393.
3. Kwong J C, Schwartz K L, Campitelli M A, et al. Acute myocardial infarction after laboratory-confirmed influenza infection[J]. New England Journal of Medicine, 2018, 378(4): 345-353.
4. Barnes M, Heywood A E, Mahimbo A, et al. Acute myocardial infarction and influenza: a meta-analysis of case–control studies[J]. Heart, 2015, 101(21): 1738-1747.
5. Koupenova M, Ravid K. Biology of Platelet Purinergic Receptors and Implications for Platelet Heterogeneity[J]. Frontiers in pharmacology, 2018, 9: 37.
6. Lopez-Delgado J C, Rovira A, Esteve F, et al. Thrombocytopenia as a mortality risk factor in acute respiratory failure in H1N1 influenza[J]. Swiss medical weekly, 2013, 143(1516).
7. Branzk N, Papayannopoulos V. Molecular mechanisms regulating NETosis in infection and disease[J]. Seminars in Immunopathology, 2013, 35(4):513-530.
8. Brinkmann V, Reichard U, Goosmann C, et al. Neutrophil extracellular traps kill bacteria[J]. science, 2004, 303(5663): 1532-1535.
9. Martinod K, Wagner D D. Thrombosis: tangled up in NETs[J]. Blood, 2014, 123(18): 2768-2776.
10. Kurt-Jones E A, Mandell L, Whitney C, et al. Role of toll-like receptor 2 (TLR2) in neutrophil activation: GM-CSF enhances TLR2 expression and TLR2-mediated interleukin 8 responses in neutrophils[J]. Blood, 2002, 100(5): 1860-1868.
链接:https://mp.weixin.qq.com/s/3faN3Ttxg6S4V3_3ikbNiA
