公共卫生学术热点追踪
Immunity | 代亚男等揭示广谱中和人源单克隆抗体对乙型流感病毒感染的预防和治疗机制
季节性流感病毒包括甲流(Influenza A virus ,IAV)和乙流(Influenza B virus ,IBV)两大类,可在人类中引起轻度至重度呼吸道感染,是主要的公共卫生问题之一。根据世界卫生组织的数据,全世界每年季节性流感会导致约300-500万严重病例和29-65万死亡病例。其中,IBV感染所引发的症状和IAV相似,尤其是小儿患者和老年人的严重疾病,IBV感染病例数量约占总感染数量的25%[1]。
目前广泛使用的四价灭活流感病毒疫苗所对应的毒株包括分别属于 Yamagata (Y) 和Victoria (V)谱系的两种IBV代表性毒株,以及分别属于H1N1和H3N2亚型的两种 IAV代表性毒株。IBV和IAV病毒结构相似,表面都包含血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA)两种关键糖蛋白抗原,它们是抗体反应的主要靶标。HA与被感染细胞表面受体唾液酸(sialic acid)的结合标志着病毒颗粒被吸附到细胞表面,开启了病毒入侵细胞的第一步。目前的流感疫苗主要通过诱导人体产生针对HA的抗体来阻断HA与受体的结合或者膜融合,从而抑制病毒的吸附和侵入。但是,越来越多的研究表明,抗体反应(以及其他因素和随机事件)所施加的进化压力迫使HA持续性地获得点突变,这一现象被称为抗原漂移(antigenic drift)效应,它使得疫苗诱导的抗体反应降低,从而大大削弱了疫苗的功效。因此,基于对全世界流行毒株的密切监控和分析预测,世界卫生组织需要每年更新两次流感疫苗的毒株组成来使之与下一季将要流行的病毒株相匹配。即便如此,目前流感疫苗的平均有效率也仅在40%左右。因此,如果能分离出靶向高度保守的交叉保护表位的人源抗体,并研究如何有效地诱导这些抗体产生,那么就能为进一步开发广谱的高保护疫苗和新的治疗手段提供重要的依据。
除HA外,神经氨酸酶(Neuraminidase,NA)是流感病毒的第二种主要糖蛋白抗原,催化切割位于N-连接的聚糖末端的唾液酸残基,减少HA与之结合。这一活性使得NA能在病毒生命周期中的数个阶段发挥作用,例如促进新生病毒颗粒从受感染细胞中逸出,以及帮助释放被呼吸道黏膜中粘蛋白等天然防御蛋白捕获的病毒等。NA的催化活性对流感病毒的感染能力至关重要。有研究表明,以重组NA蛋白免疫小鼠得到的多克隆抗体在小鼠模型中可保护其抵抗致死量流感病毒的攻击[2];粘膜抗IBV NA抗体可预防豚鼠的病毒传播[3]等等。此外,许多被批准的小分子抗流感病毒药物也以NA作为作用靶标。例如,奥司他韦(Oseltamivir)通过结合NA的活性位点来抑制其催化能力,它是目前最广泛使用的,也是美国食品药品监督管理局批准的唯一可用于2周岁以下儿童的抗病毒药物[4]。值得注意的是,小分子NA抑制剂对IBV感染的治疗效果比IAV要差,而儿童相较于成人易感染IBV,这就使得对IBV感染的治疗更为复杂。以上数据表明抑制NA的活性可以预防和治疗流感病毒的感染,然而,NA在疫苗开发方面却被很大程度地忽略了。当前的灭活流感病毒疫苗可能含有NA抗原,但是其数量和质量却没有统一化的标准。此外,关于靶向NA免疫的保护作用,仍有诸多问题悬而未决。而与IAV相比,抗体介导的针对IBV NA的免疫的研究更是不足,例如,IBV NA的保护表位,抗原漂移的可能性和抗体保护作用的广度和机制等等。
2020年9月24日,圣路易斯华盛顿大学医学院的Ali H. Ellebedy 教授和Daved H. Fremont教授研究组以及来自西奈山伊坎医学院的Florian Krammer教授研究组合作在Immunity杂志上在线发表了题为“Humanantibodies targeting influenza B virus neuraminidase active site are broadlyprotective” 的论文,阐述了广谱中和人源抗NA单克隆抗体对乙流感染的预防和治疗机制。这也是靶向乙流NA的交叉中和抗体的首次系统性研究。

作者首先从一名感染了IBV的住院患者抽取血液样本,并分离出产生抗体的细胞,接着通过单细胞测序和重组表达单克隆抗体(mAbs),鉴定了7个靶向IBV NA的单克隆抗体 (BNA-mAbs)。这7个抗体针对多个IBV毒株均表现出不同程度的NA抑制能力,其中抗体1G05和2E01的表现尤为突出。它们不仅能抑制来自Yamagata (Y) 和Victoria (V)两个谱系的多个IBV毒株的NA活性,对“祖先” 毒株B/Lee/1940也有显著的NA抑制能力,表明了其优越的广谱抑制能力。针对Yamagata (Y) 和Victoria (V)两个谱系的代表性IBV毒株的体外中和实验表明,7个抗体中的6个均体现了不同程度的中和能力,1G05和2E01的中和能力也相对最强。进一步的感染小鼠模型结果表明,所有抗体均具备针对致死量B / New York / PV00094 / 17(Y)毒株感染的预防能力。此外,作者用致死剂量的B / New York / PV00094 / 17(Y)来感染小鼠,然后在72小时后分别注射BNA-mAbs来评估其治疗潜力,结果显示各组小鼠的体重均有不同程度的减轻,但是2E01提供了100%的保护,而1G05则保护了80%的小鼠免于死亡[图1]。这些数据表明,BNA-mAbs在小鼠模型中可抵抗致命的IBV感染,而1G05和2E01 的预防和治疗能力尤为显著。
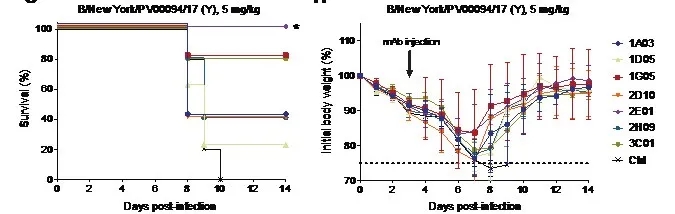
图1.小鼠存活率(左)和体重百分比(右)
为了进一步阐明NA的抗原表位,以及1G05和2E01的保护机制,作者利用单粒子冷冻电镜技术解析了1G05和2E01的抗原结合片段(antigen-binding fragment ,Fab)和 NA的复合物结构[图2]。NA为四聚体,每一个单体结合一个Fab片段。
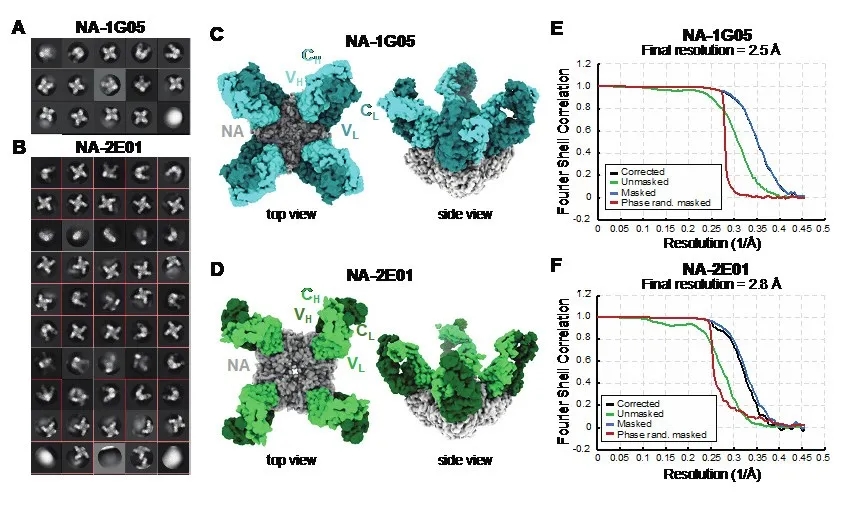
图2.NA-1G05和NA-2E01的冷冻电镜结构
结构分析表明,1G05和2E01都通过将其重链可变区CDR-H3loop(Complementarity-determining region)伸入NA的活性口袋,并且与一组保守的催化残基相互作用来实现抑制NA的功能。这种结合模式和NA与其底物和抑制剂的结合总体相似,但相比2E01,1G05的CDR-H3loop更长,形成的作用网络也更为广泛[图3]。
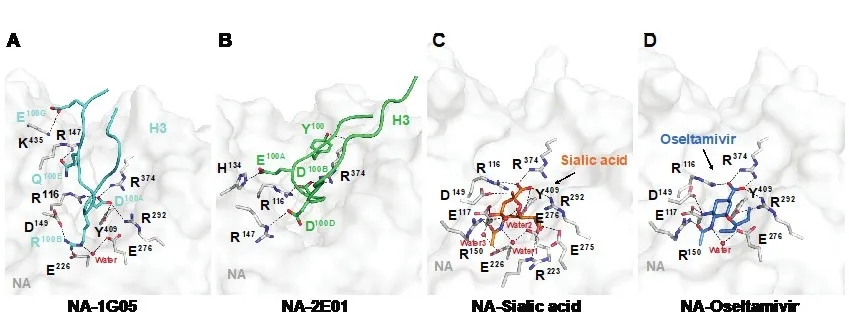
图3. NA活性口袋分别与抗体,底物,抑制剂相互作用模式比较
此外,作者还发现1G05和2E01对两个奥司他韦耐药IBV毒株仍具备非常好的NA抑制活性,进一步表明了1G05和2E01具备作为药物来治疗IBV的潜力。综上,该项研究首次报道了人源的靶向乙型流感病毒NA的交叉中和抗体,为治疗IBV感染以及开发广谱流感疫苗提供了重要的理论依据。
此项研究工作由来自圣路易斯华盛顿大学医学院的Ali H. Ellebedy 教授和Daved H. Fremont教授研究组以及来自西奈山伊坎医学院的Florian Krammer教授研究组合作完成。来自挪威卑尔根大学的Anders Madsen博士,来自Fremont实验室的代亚男(Ya-Nan Dai)博士,以及来自Krammer实验室的Meagan McMahon博士为论文共同第一作者。
(来源:BioArt)
参考文献:
1. Paul Glezen, W., Schmier, J.K., Kuehn, C.M., Ryan, K.J., and Oxford, J.(2013). The burden of influenza B: a structured literature review. Am. J.Public Health 103, e43–e51.
2. Wohlbold, T.J., Nachbagauer, R., Xu, H., Tan, G.S., Hirsh, A., Brokstad,K.A., Cox, R.J., Palese, P., and Krammer, F. (2015). Vaccination withadjuvanted recombinant neuraminidase induces broad heterologous, but notheterosubtypic, cross-protection against influenza virus infection in mice.MBio 6, e02556.
3. McMahon, M., Kirkpatrick, E., Stadlbauer, D., Strohmeier, S., Bouvier,N.M., and Krammer, F. (2019). Mucosal Immunity against Neuraminidase PreventsInfluenza B Virus Transmission in Guinea Pigs. MBio 10, e00560-19.
4. Burnham, A.J., Baranovich, T., and Govorkova, E.A. (2013). Neuraminidasein- hibitors for influenza B virus infection: efficacy and resistance.Antiviral Res. 100, 520–534.
链接:https://linkinghub.elsevier.com/retrieve/pii/S1074761320303721
