公共卫生学术热点追踪
Science | 首次在人体中证实:多种神经退行性疾病均可影响海马齿状回的神经发生
成人神经发生主要发生在成年哺乳动物大脑的特定区域,例如海马齿状回和脑室下区/嗅球系统。在海马体中神经干细胞产生新神经元的过程被称为成人海马神经发生(adult hippocampal neurogenesis,AHN),这一过程可以增加海马体的可塑性。AHN在学习、记忆和情绪调节方面至关重要,且与记忆缺陷有关[1, 2]。在前期小鼠模型的研究中得以证实,新的神经元主要来自海马齿状回颗粒下区的神经干细胞 。
那么,神经发生的改变为什么对神经退行性疾病很重要呢?神经退行性疾病与病理性蛋白错误折叠相关,伴随着不同脑域神经元的丧失,同时成体大脑细胞更新的内源能力和新神经元的功能也受到损害。因而神经发生的改变是神经退行性疾病的共同特点。神经退行性疾病导致的认知障碍及相关精神症状与海马功能及结构的损伤有较强的相关性,而其潜在的神经退行性过程也可改变海马可塑性,使其脆弱性增加。所以,在不同神经退行性疾病的背景下,不同的感觉、情绪和认知障碍可能存在与神经发生功能的改变相关。然而,截至目前,AHN与海马功能之间的联系、AHN和神经退行性疾病之间的关联还没有在人体中得到证实。
2021年10月21日,来自西班牙马德里自治大学Severo Ochoa分子生物学中心的M. Llorens-Martín课题组在Science上发表了(First release)题为“Impact of neurodegenerative diseases on human adult hippocampal neurogenesis”的文章,通过对人体尸检标本海马齿状回微生态位稳态和AHN动态的研究,首次确认了AHN和海马功能之间存在的潜在联系,并证实了AHN对不同神经退行性疾病的影响,包括对肌萎缩侧索硬化(ALS)、亨廷顿舞蹈症(HD)、帕金森病(PD)、路易体痴呆(LBD)、以及额颞叶痴呆(FTD)。

首先,作者检测了神经系统健康对照受试者中的AHN (图1)。
已知人类齿状回中含有未成熟的齿状颗粒细胞(dentate granule cells,DGCs),但是否与小鼠模型类似,存在具有神经干细胞功能的放射状胶质细胞样细胞(radial glia-like(RGL)cells),还没被证实。在此,通过对人尸检标本的检测,作者们发现了具有神经干细胞特性的巢蛋白(Nestin+)细胞,并表达RGL相关的标记物,如Sox2(SRY-box 2)、Vimentin (波形蛋白)、GFAP(神经胶质纤维酸性蛋白)。这些Nestin+细胞与海马神经干细胞有一定的形态相似性,如Nestin+细胞的胞体分布于马齿状回颗粒下区。同时在该颗粒下区也可检测到了一些增殖性的细胞,包括磷酸组蛋白3 (PH3)+ 增殖性细胞、 HuC/HuD+ 增殖性神经母细胞。这些Nestin+细胞的存在提示人类海马神经干细胞池在整个生命过程中都存在。与之前已报到的结果相一致,这些人类DGC经鉴定是具有神经源性能力的前体颗粒细胞,维持神经干细胞的增殖能力。
未成熟的DGC在成熟前会经历不同的分化阶段,且已知多种神经元标记物可以表征DGC的成熟和分化阶段,比如微管相关蛋白双皮质素(DCX)表征未成熟神经元, HuC/HuD表征增殖性神经母细胞,NeuN(神经元核)、2MAP-2(微管相关蛋白 2)、3R Tau、钙结合蛋白 (CB)等表征更加分化的DGCs。这些标记物在其DGC成熟过程中发生表达变化,且细胞定位、神经突方向都会改变。如图1所示,最不成熟的DGC, DCX和CR 位于细胞颗粒下层(SGZ),很小且具有水平定向的初级顶端神经突 ;出现更多分化的DGC,DCX和CB占据颗粒细胞层 (GCL)的上部位置,更大并具有单一的初级顶端神经突;接下来,DGC中检测到NeuN和DCX,则表征了DGC成熟的中间状态。因此这种DGC的动态变化表明了人类 AHN 的动态特性。
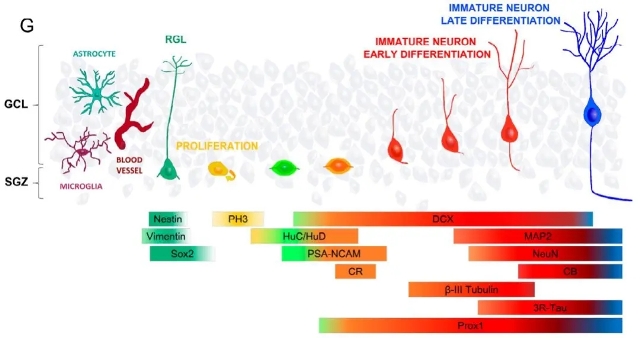
图1 神经健康对照受试者中AHN的不同阶段
(图源:J. Terreros-Roncal et al., Science, 2021)
啮齿动物模型研究表明,AHN受到状回区域中神经源性微生态位(neurogenic niche)的调控,包括星形胶质细胞、小胶质细胞以及血管系统。在本研究中,作者也观察到,在健康的人齿状回颗粒细胞层(GCL)表面,除了分布有大量未成熟的DGC、RGL细胞,还有丰富的星形胶质细胞和小胶质细胞。其中小胶质细胞通过控制新生神经元成熟来调节AHN [7]。有趣的是,作者注意到,小胶质细胞呈现出特殊的膜结构:“吞噬囊袋(phagocytic pouches)”(图2),吞噬功能失调的细胞,在健康老年受试者中这种吞噬囊袋数量减少,这表明小胶质细胞表型出现局部功能性失调;小胶质细胞功能的改变可能是人类中与年龄相关的AHN降低的基本机制之一。
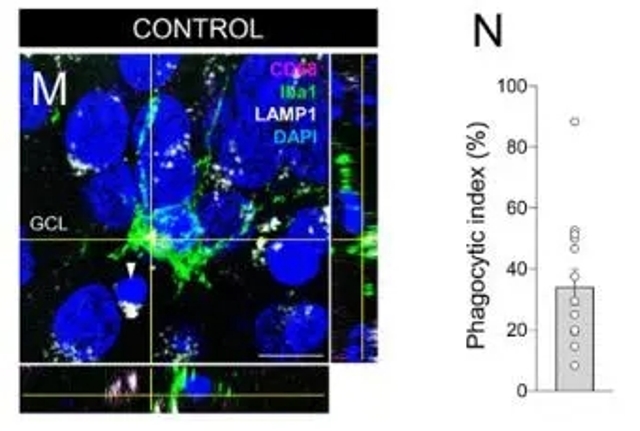
图2 小胶质细胞吞噬囊袋
(图源:J. Terreros-Roncal et al., Science, 2021)
接下来,作者检测在不同神经退行性疾病中AHN的变化(图3)。
首先检测了AHN对肌萎缩侧索硬化(ALS)的易感性。发现ALS患者齿状回PH3+增殖性细胞和 HuC/HuD+增殖性神经干细胞的密度保持不变,表明海马体在ALS中保留了增殖能力。而神经干细胞和未成熟DCX+ DGC的密度增加,DGC形态发育受损。作者也检测了齿状回中的神经源性微生态,发现星形胶质细胞增生、小胶质细胞吞噬囊袋数量减少、毛细血管增厚。这些结果表明:AHN 和齿状回神经源性生态位的稳态都容易受到ALS的影响。
然后作者又研究了亨廷顿舞蹈症(HD)对AHN的影响。发现 Sox2+细胞和增殖性细胞的密度不变,Nestin+神经干细胞细胞和未成熟DGC的密度增加。未成熟DGC表现出早熟损伤,出现形态异常,NeuN表达下降。齿状回神经源性微生态位的稳态也受到与上述ALS中类似的影响。这些结果表明:AHN和齿状回稳态对HD的易感性增加,在患有HD的新生儿中,DGC表现出早期晚期的成熟损伤,导致其停留在未分化阶段。
接下来作者检测了α-突触核蛋白病对AHN的影响。帕金森病(PD) 和路易体痴呆(LBD)是两种最常见的α-突触核蛋白病。本研究发现,患有这两种疾病的患者均表现出RGL细胞的密度增加、未成熟DCX+ DGCs的形态异常。PD患者非LBD患者表现出HuC/HuD+增殖性神经母细胞和DCX+未成熟DGC的密度增加,NeuN的表达降低。在神经源性微生态位的检测中,PD和LBD患者均出现了齿状回毛细血管厚度的增加,其中PD患者中还发现小胶质细胞吞噬能力受损和齿状回星形胶质细胞增生。这些结果表明:这两种 α-突触核蛋白病均靶向齿状回环境并产生相似的AHN 特征,但PD患者表现出更严重的损伤,LBD患者对AHN改变和齿状回神经源性微生态位改变的影响相对温和。
最后作者发现额颞叶痴呆(FTD)患者也表现出轻微的AHN改变。主要表现为神经干细胞和未成熟DGCs的密度不变,但HuC/HuD+ 增殖性神经元密度降低、DGC分化轻微受损。齿状回神经源性微生态位也受到轻微影响,表现为星形胶质细胞增生、毛细血管厚度增加、小胶质细胞吞噬能力呈指数降低的趋势。这些结果表明:FTD可以通过改变RGL细胞和增值性细胞的比例的平衡、引起形态异常的齿状颗粒细胞、以及紊乱齿状回神经源性的微生态位来影响AHN。
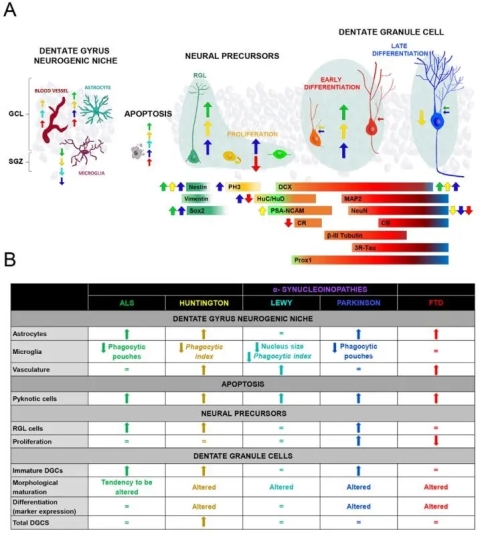
图3 各种神经退行性疾病中AHN的改变
(图源:J. Terreros-Roncal et al., Science, 2021)
文章结论与讨论,启发与展望
该研究首次建立了人类中AHN和海马功能之间的关联,探索了人正常生理状况下AHN在不同时期的变化及其相关的影响因素,并研究了健康人齿状回神经源性微生态位如何被调控以及如何影响AHN。
也首次揭示了人类 AHN对不同神经退行性疾病的易感性。在不同的神经退行性疾病中,AHN出现不同程度的变化,不同程度的GCL细胞和增殖细胞(如增值性神经干细胞)的比率变化,以及神经源性微生态位稳态的不同改变。总之,不同的疾病、同一疾病的不严重程度,这些变都不同。
该研究也发现了正常衰老和神经退行性疾病都降低了小胶质细胞吞噬能力,引发了星形胶质细胞增生,并改变了齿状回的血管系统,且已有报道表明这些改变会影响AHN [8, 9],因此提示AHN损伤可能是人类正常生理衰老和疾病病理衰老过程中海马功能障碍的一种共同机制。因此,在未来的研究中,揭示人类齿状回神经源性微生态位因素和AHN动态因素之间的关联,有助于我们理解AHN的生理功能,特别是AHN在整个人类生命过程中对大脑可塑性的生理功能。
同样值得关注的是,比如,本研究中尸检标本数量不够大(一共48例),因此是否具有一定的普遍性还有待进一步的考证。另外相对较常见的神经推行性疾病阿尔兹海默病没有在本文中得以检测,且原因没有阐明。
(来源:中国生物技术网)
原文出处:J. TERREROS-RONCAL , P. MORENO-JIMéNEZ, FLOR-GARCíA, et al. Impact of neurodegenerative diseases on human adult hippocampal neurogenesis[J].Science. 21 Oct 2021.
链接:https://www.science.org/doi/10.1126/science.abl5163
