公共卫生学术热点追踪
杨威/王健伟/丁强团队在新冠病毒广谱中和纳米抗体方面取得新进展
新型冠状病毒(SARS-CoV-2)大流行已持续两年多,截至2022年2月全球已有近六百万人因感染SARS-CoV-2死亡。近期席卷全球的奥密克戎(Omicron)变异株史无前例地在其Spike刺突蛋白上出现32个突变,其中在受体结合区(RBD)就有高达15个突变位点,进而产生免疫后突破感染,并导致绝大多数已上市中和抗体药物失效。为提高疫情应对能力,亟需研发能够针对多种突变株的具有广谱保护性的新一代中和抗体药物。
近日,中国医学科学院病原生物学研究所杨威课题组、王健伟课题组联合清华大学医学院丁强课题组,从构建的第二代纳米抗体库中分离获得多个具有交叉保护活性的纳米中和抗体,对已发现的多种新冠病毒VOC变异株有很好的广谱抑制作用。相关研究工作于2022年2月9日以长文形式发表在Signal Transduction and Targeted Therapy,题为An ultrapotent RBD-targeted biparatopic nanobody neutralizes broad SARS-CoV-2 variants 。

研究者利用新搭建的第二代高容量全合成纳米抗库平台,经过优化的筛选流程并结合创新性的设计策略,选择能够结合RBD的RBM表位及保守outer face表位的多价双表位设计,筛选获得对多种SARS-CoV-2突变株具有广谱中和活性的纳米抗体Nb1-Nb2。分别利用假病毒颗粒和反式互补病毒工具发现,Nb1-Nb2具有广谱中和多种SARS-CoV-2变体的能力,包括Alpha、Beta、Gamma、Delta、Lambda、Kappa、Mu和Omicron。为了确定Nb1-Nb2对可能出现的新的突变的中和能力,文中通过深度突变扫描实验鉴定了RBD上Nbs的潜在结合表位,并证明双表位Nb1-Nb2对60多个被测RBD氨基酸取代具有很强的逃避抗性。
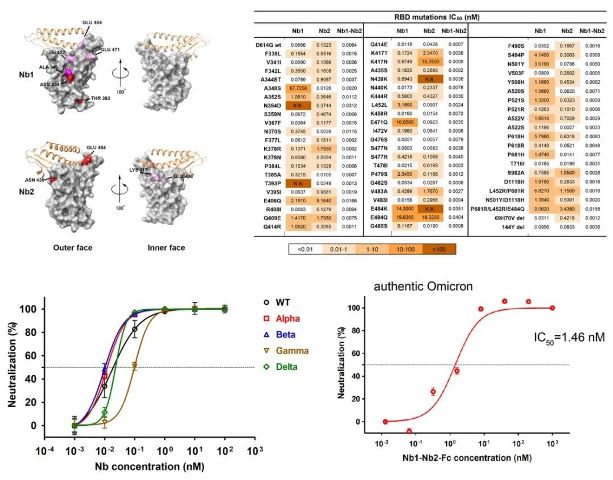
随后研究者通过融合人IgG1的Fc片段构建成全新形式的人重链抗体(Nb1-Nb2-Fc),从而全面提高了抗体的中和活性、产率、蛋白稳定性并延长了其潜在的半衰期。针对新的Omicron变种,Nb1-Nb2-Fc保持了牢固的亲和力(KD<1.0E-12 M)和强大的中和活性(Omicron活病毒,IC50=1.46 nM)。
综上研究结果表明,通过筛选获得的识别双表位的纳米中和抗体对变异毒株具有广谱性,能有效抵御能通过突变出现的新冠变异毒株,且由于该抗体来源于纳米抗体,具有生产成本低等优势,未来通过方便的雾化吸入抗体给药等方式,对早发现的和轻微症状的感染者给与干预治疗,降低住院率,甚至用于高危场景的预防,都具有十分重要的意义,具有较高的开发应用价值。项目团队正在全力以赴进行临床前开发工作。
杨威研究员、王健伟研究员和丁强助理教授为论文共同通讯作者,迟晓静副研究员、研究生张心慧、潘胜男、于晏璎和史玉金为论文共同第一作者。
(来源:BioArtMED)
原文出处:Chi, X., Zhang, X., Pan, S. et al. An ultrapotent RBD-targeted biparatopic nanobody neutralizes broad SARS-CoV-2 variants. Sig Transduct Target Ther 7, 44 (2022). https://doi.org/10.1038/s41392-022-00912-4
链接:https://www.nature.com/articles/s41392-022-00912-4
