公共卫生学术热点追踪
高福院士团队在冠状病毒跨种识别马ACE2受体的分子机制研究中取得进展
2022年6月21日,中国科学院微生物研究所高福院士团队在Nature Communications上发表了题为“Binding and structural basis of equine ACE2 to RBDs from SARS-CoV, SARS-CoV-2 and related coronaviruses”的研究论文1。该研究评估了SARS-CoV-2及其相关动物来源冠状病毒与马受体ACE2的结合并解析了马ACE2与SARS-CoV-2、OmicronBA.1、蝙蝠来源冠状病毒RaTG13受体结合域(RBD)的晶体结构,阐明了其相互作用的分子机制。
SARS-CoV-2可由人向多种动物传播且可能回传给人类2。因此,寻找SARS-CoV-2可能的动物宿主对于监测其在动物中的传播并降低动物回传人的风险十分重要。此外,自COVID-19疫情暴发以来,全球多个地方在不同动物,尤其是蝙蝠中检测到多个新冠相关冠状病毒,其中蝙蝠冠状病毒RaTG13与SARS-CoV-2同源性较高,为96.2%。此前,高福院士团队研究发现RaTG13 RBD与马ACE2具有较强的结合能力3,因此,研究马ACE2与SARS-CoV-2及其相关冠状病毒RBD的结合以及结合的分子机制,对评估马在冠状病毒演化与起源的作用及其作为中间宿主的可能性具有重要意义。
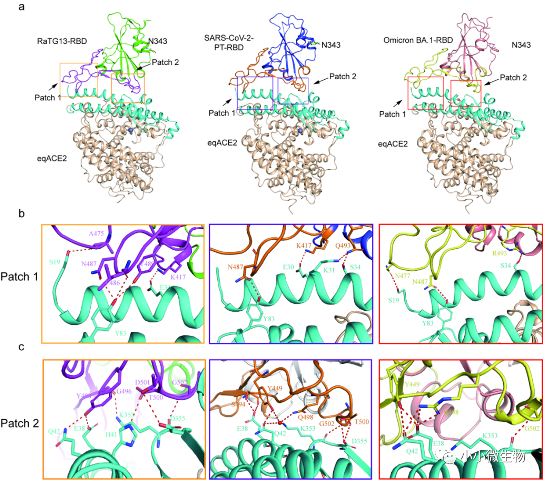
图1 马ACE2与SARS-CoV-2、RaTG13和Omicron BA.1 RBD相互作用的分子机制
该研究首先通过表面等离子共振技术(SPR)测定了马ACE2与动物来源冠状病毒的结合能力,发现马ACE2能够广泛结合多种冠状病毒RBD。自COVID-19疫情发生以来,出现了众多变异株。因此,研究团队比较了马ACE2结合不同变异株RBD的能力,结果发现虽然多种变异株RBD,如:Alpha、 Beta、Gamma等结合人ACE2的能力提高,但是其结合马ACE2的亲和力减弱。为进一步揭示马ACE2与冠状病毒RBD结合的分子机制,团队解析了其与 SARS-CoV-2原始株、Omicron BA.1变异株以及RaTG13 RBD的复合物晶体结构。结构分析发现多个关键氨基酸影响马ACE2与不同RBD的结合,特别是SARS-CoV-2 RBD上的S494对于结合马ACE2起到关键作用。值得注意的是,N501Y的突变可提高SARS-CoV-2 RBD结合人、狗、小鼠ACE2的亲和力,但却降低了结合马ACE2的能力。该研究有助于评估SARS-CoV-2与相关冠状病毒感染马的跨种传播能力,同时提示要对马等动物进行监测,预防其成为SARS-CoV-2等冠状病毒的新宿主,进而引发新的疫情。
中国科学院微生物研究所高福院士团队博士后刘科芳博士与王奇慧研究员为该文章的共同通讯作者。中国科学院大学本科生徐泽鹏(现为澳门大学与中国科学院大学联合培养博士研究生),中国科学院大学存济医学院硕士研究生康新锐,中国科学院微生物研究所博士后韩普博士和杜沛副研究员为共同第一作者。该项目得到了中国科学院战略性先导专项、国家自然科学基金、中国博士后面上基金和中国科协青年人才托举工程等经费支持。
(来源:小小微生物)
参考文献:
[1] Xu Z, Kang X, Han P et al. Binding and structural basis of equine ACE2 to RBDs from SARS-CoV, SARS-CoV-2 and related coronaviruses. Nat Commun 2022.
[2] Gao GF, Wang L. COVID-19 expands its territories from humans to animals. China CDC Weekly 2021; 3:855-858.
[3] Liu K, Pan X, Li L et al. Binding and molecular basis of the bat coronavirus RaTG13 virus to ACE2 in humans and other species. Cell 2021; 184:3438-3451.e3410.
链接:https://mp.weixin.qq.com/s/kTAQm28ebugWhQI1kqEa8g
