公共卫生学术热点追踪
Nat Immunol | 张志荣等揭示激活先天免疫的新机制——NLRP3炎症小体感应内吞体应激
炎症小体是一种多蛋白聚合复合体,在病原体入侵或者组织损伤引起的先天免疫反应中起这关键性作用。经典的炎症小体由模式识别受体(Pattern recognition receptors)、效应蛋白半胱天冬酶Caspase1和支架蛋白ASC组成。这些模式识别受体包括Nod样受体 (Nod-like receptors) 家族成员、AIM2样受体 (AIM2-like receptors)家族成员及Pyrin等。在被激活后,模式识别受体发生多聚化,然后募集ASC和Caspase1酶原组装成炎症小体,进而活化Caspase1。活化的Caspase1一方面剪切促炎症细胞因子白介素-1β (IL-1β)和白介素-18 (IL-18) 前体促进其成熟和释放;另一方面,活化的Caspase1剪切Gasdermin D释放其N段活性片段,后者在细胞膜上打孔并引发溶解性细胞死亡,也称为细胞焦亡 (Pyroptosis) 。
不同的炎症小体能够被特定机制激活,大部分炎症小体的模式识别受体能够识别某一种或者一类刺激物。然而,NLRP3 (NLR family pyrin domain-containing protein 3) 炎症小体属于一个特例,因为它能够被很大范围的、一系列的刺激物所激活,包括细胞外ATP,细菌毒素,难溶性颗粒物和病原微生物等等。通常认为,NLRP3炎症小体的激活一需要两个信号步骤,即预处理(Priming) 和激活 (Activation)。预处理信号可以通过Toll样受体或者细胞因子受体激活来获得,激活NF-κB信号通路促进NLRP3和细胞因子的转录和翻译, 同时也可能引起NLRP3翻译后修饰的改变;激活信号则是由前面提到的刺激物所介导来引发炎症小体的组装。取决于这些刺激物的特性,已经提出了多种不同机制能够介导NLRP3炎症小体的激活和组装。大部分刺激物是通过引发胞内钾离子外泄 (Potassium efflux),进而激活NLRP3炎症小体。然而,关于NLRP3识别感应的分子机制仍然是个谜团,这也是该领域内一个长期以来急需解决的生物学问题。
2022年11月28日,来自法国遗传分子细胞生物研究所 (IGBMC) 的张志荣和Romeo RICCI团队和来自意大利Telethon遗传与医学研究所 (TIGEM) 的Antonella de Matteis团队合作在Nature Immunology上在线发表了Distinct changes in endosomal composition promote NLRP3 inflammasome activation的文章,揭示了NLRP3炎症小体激活的细胞生物学机制:NLRP3的激活发生在内吞体上,NLRP3 能够感应内吞体应激情况下其组分的变化。

先前报道称NLRP3能够被募集到富含PI4P (Phosphatidylinositol 4-phosphate) 的囊泡上并且这一过程对其激活非常重要[1]。通过解析这一囊泡的生物学属性,该研究的作者发现NLRP3阳性的囊泡带有早期内吞体 (early endosome) 的标记分子,包括EEA1, RAB5和SNX2。同时在通过Transferrin loading来标记早期内吞体的实验中,作者也同样观察到NLRP3被募集到同时富含PI4P和Transferrin的早期内吞体上。NLRP3募集到早期内吞体后被激活并能够启动炎症小体的组装。这些实验结果表明NLRP3的激活是发生在早期内吞体上,而不是在之前报道的源自反式高尔基网络 (Trans-Golgi network, TGN) 的囊泡上[1]。通过调控负责PI4P合成的激酶PI4Ks (Phosphatidylinositol 4-kinases) 和负责PI4P降解的磷酸酶的活性,作者进一步证实了内吞体上的,而不是源自TGN的囊泡上的,PI4P对NLRP3的激活起关键性作用。
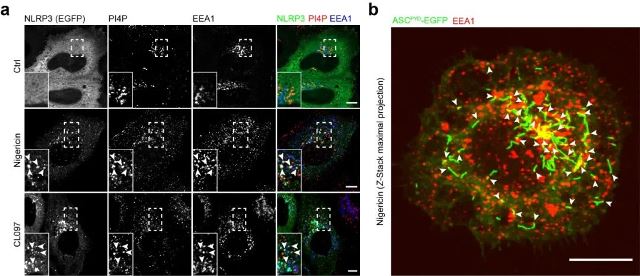
图1 NLRP3的激活发生在内吞体上
PI4P为什么会在内吞体上富集呢?在深一步的研究过程中,作者惊奇地发现NLRP3激活物能够破坏内吞体与内质网间膜接触位点 (Endosome-ER contact site, EECS),进而导致内吞体上PI4P的富集。这一现象与之前关于EECS在精细调控内吞体上PI4P水平中起至关重要作用的报道相符[2,3]。在内质网锚定蛋白VAPs (VAPA和VAPB) 或者内吞体上的PI4P转移蛋白OSBP缺失的HeLa细胞 (不表达ASC) 中,PI4P在内吞体上大量富集同时NLRP3能够被自发募集到内吞体上。与此同时,作者在THP-1细胞中敲除VAPs或者OSBP后,发现在这些细胞能够在只有LPS预处理的情况下激活NLRP3炎症小体。这些结果表明,NLRP3激活物通过破坏EECS导致PI4P在内吞体上富集,进而促进NLRP3被募集到内吞体上并引发炎症小体激活和组装。
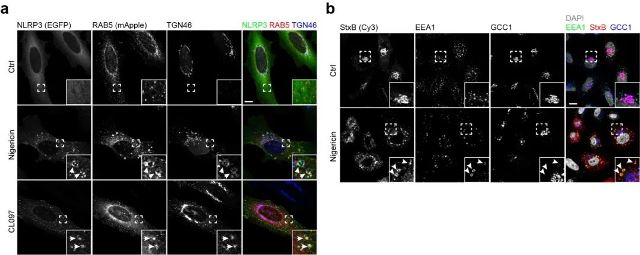
图2 NLRP3激活阻断ETT,导致TGN货物在内吞体的阻滞
之前的研究已显示内吞体上PI4P的富集会扰乱内吞体的正常分裂 (fission) 及货物分选,进而影响靶向TGN的货物从内吞体到TGN的运输 (Endosome-to-TGN trafficking, ETT)。这类货物包括在细胞膜-内吞体-TGN间循环运输的TGN46。因此,作者追踪了TGN46在NLRP3激活物刺激下的细胞中的亚定位。实验结果显示:在NLRP3激活物刺激下,TGN46的细胞亚定位发生改变,定位在NLRP3阳性的内吞体上面。这一现象暗示了TGN46从内吞体到TGN的运输可能被阻断。通过追踪志贺样毒素 (Shiga-like toxin) 及另一个TGN货物CI-MPR在同等条件下细胞中运输,作者进一步证实了NLRP3激活物能够阻断内吞体到TGN的运输,从而导致靶向TGN的货物,包括TGN46,在内吞体上的滞留。作者同时观察了那些含有GRIP结构域的TGN标记分子 GCC1/GCC88,GCC2/GCC185, Golgin97和Golgin245/p230在同等刺激条件下的细胞亚定位,实验结果显示这些分子在NLRP3激活物的刺激下的细胞中的亚定位没有明显的变化。由于这些标记分子在TGN上的定位不依赖于ETT,所以排除了之前研究提出的关于TGN被解散的可能性[1]。
最后,作者进一步揭示了ETT的阻断并不仅仅是NLRP3激活物刺激引起的一个副作用,而是有积极参与NLRP3的激活过程。在ETT缺失的细胞中,作者观察到类似于VAPs或者OSBP缺失的细胞中观察到的现象,即PI4P在内吞体上富集和NLRP3被自发募集到内吞体上并被激活。另外,髓系细胞EET缺失的小鼠对LPS引起的内毒素血症更加敏感,而且这主要是由NLRP3炎症小体的超激活所致。
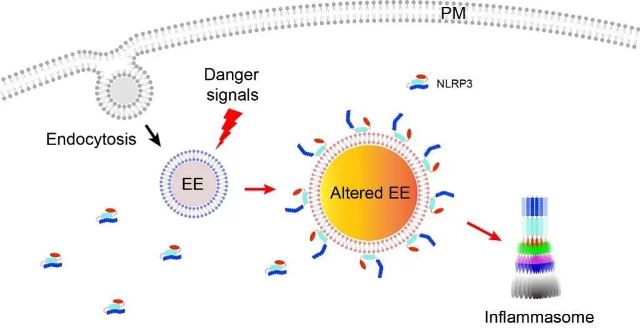
图3 NLRP3感应识别机制的新模型
综上所述,该研究工作揭示了NLRP3炎症小体的激活发生在内吞体上,为未来NLRP3炎症小体的研究提供了新的指导方向;同时阐明了NLRP3激活物导致内吞体功能受损的详细分子机制;提出了NLRP3感应识别的新模型-NLRP3感应识别内吞体在应激情况下上特定组分的改变。
(来源:BioArt)
参考文献:
1. Chen, J. & Chen, Z. J. PtdIns4P on dispersed trans-Golgi network mediates NLRP3 inflammasome activation. Nature 564, 71–76 (2018).
2. Dong, R. et al. Endosome-ER Contacts Control Actin Nucleation and Retromer Function through VAP-Dependent Regulation of PI4P. Cell 166, 408–423 (2016).
3. Rowland, A. A., Chitwood, P. J., Phillips, M. J. & Voeltz, G. K. ER contact sites define the position and timing of endosome fission. Cell 159, 1027–1041 (2014).
