公共卫生学术热点追踪
PLoS Pathogens|病毒国重刘昱研究组揭示DDOST促进抗病毒免疫信号分子MITA寡聚化活化的作用机制

2022年11月30日,国际学术期刊PLOS Pathogens杂志在线发表了武汉大学病毒学国家重点实验室/生命科学学院刘昱教授课题组的最新成果,论文题目为“MITA oligomerization upon viral infection is dependent on its N-glycosylation mediated by DDOST”(病毒感染诱导的MITA寡聚化依赖于DDOST介导的N-糖基化),DOI: 10.1371/journal.ppat.1010989。
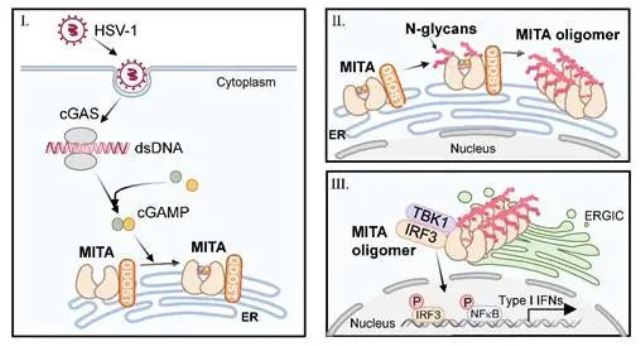
cGAS-MITA信号通路是细胞识别胞质中异常DNA并启动天然免疫反应的重要途径之一。作为此通路中重要的接头蛋白,MITA的活化受到多种蛋白质翻译后修饰的精密调控。刘昱课题组前期在蛋白质质谱数据库中,发现与MITA相互作用的候选蛋白包括寡糖基转移酶(OST)复合物中的多个亚基;并通过内源性免疫共沉淀实验,确定HSV-1感染能增强或诱导MITA与含DDOST在内的OST-B复合物多个亚基的相互作用。在THP-1细胞中敲低OST复合物的多个组分能显著抑制MITA介导的抗病毒天然免疫通路活化,同时增强病毒复制。由于HSV-1潜伏感染有可能造成致命的病毒性脑炎,而转录组数据显示DDOST等OST复合物成员在脑中的表达显著低于外周组织,提示OST复合物在脑中的低表达有一定生理意义。
在确定了DDOST缺失影响病毒诱导的MITA转运、招募下游信号分子和磷酸化后,课题组通过糖基化实验发现HSV-1感染可诱导新合成MITA发生N-糖基化修饰,此修饰由DDOST介导。质谱鉴定结果表明,病毒感染诱导MITA在N183、N211和N242位点发生显著的、DDOST依赖的N-糖基化修饰。将这三个天冬酰胺突变成丙氨酸或谷氨酰胺后,可以显著抑制病毒诱导的MITA寡聚化活化和MITA介导的抗病毒免疫反应。通过对MITA二聚体晶体结构的分析,作者推测MITA在N242位点的糖基化有助于其结合cGAMP活化,而介于MITA二聚体与相邻二聚体交界面的N183和N211的糖基化有助于MITA寡聚体的组建。
作者进一步采用腺病毒载体递送系统结合脑立体定位技术,使DDOST在小鼠海马组织中高表达;随后构建HSV脑炎模型,发现DDOST高表达组海马区小胶质细胞浸润明显增强,干扰素和炎症因子转录显著提高,海马组织的病毒量也明显低于对照组。HSV脑炎致死实验也表明DDOST高表达能显著降低小鼠HSV脑炎死亡风险。
该研究首次报道了MITA活化所需的新型翻译后修饰机制——N糖基化修饰及其分子机制,并通过HSV脑炎模型验证了DDOST在个体水平上的抗病毒免疫功能,提示大脑神经元中DDOST及其相关寡聚糖复合物成员的低表达可能是防止脑组织免疫病理损伤的保护性机制,但与此同时也增加了发生病毒性脑炎的风险。综上,该研究对DDOST介导的MITA糖基化在抗病毒天然免疫中的作用机制进行了解析,丰富了对抗病毒免疫机制的认识,也为病毒性脑炎的发病机制研究提供了新思路。
武汉大学生科院刘昱实验室2019级博士生涂怡为本研究的第一作者,刘昱教授为本研究的通讯作者,武汉大学生科院殷雷教授为共同作者。该研究工作得到了蓝柯教授、周严教授、王琰教授和刘勇教授的大力支持和帮助,也得到了国家科技部重点研发计划和国家自然科学基金面上项目的经费资助。
(来源:病毒学国家重点实验室)
原文出处:Tu Y, Yin XJ, Liu Q, Zhang S, Wang J, Ji BZ, Zhang J, Sun MS, Yang Y, Wang CH, Yin L, Liu Y. MITA oligomerization upon viral infection is dependent on its N-glycosylation mediated by DDOST. PLoS Pathog. 2022 Nov 30;18(11):e1010989. doi: 10.1371/journal.ppat.1010989. PMID: 36449507.
链接:https://pubmed.ncbi.nlm.nih.gov/36449507/
