公共卫生学术热点追踪
JMV|北京大学彭宜红教授课题组揭示肠道病毒2A蛋白ST125磷酸化是病毒宿主适应性的新机制
2022年12月,北京大学医学部彭宜红教授课题组在国际病毒学期刊《Journal of Medical Virology》(IF=20.693)在线发表题为“Phosphorylation of Enteroviral 2Apro at Ser/Thr125 Benefits Its Proteolytic Activity and Viral Pathogenesis”的研究论文,阐明了肠道病毒2A蛋白Ser/Thr125磷酸化有益于病毒的复制及致病性,揭示了肠道病毒宿主适应性的新机制。
肠道病毒(enteroviruses, EV)是人类新发和高发传染病的重要病原,但针对大多数EVs感染,目前尚无有效疫苗和抗病毒药物。自上个世纪90年代起,肠道病毒2A蛋白酶(2Apro)就被发现在病毒的复制和致病中具有重要作用,但其执行重要功能过程中的调控机制并不完全清楚。揭示相关机制,对于深入认识肠道病毒基本规律并建立有效的肠道病毒防控策略,具有重要的理论意义和广泛的社会需求。

彭宜红教授课题组前期工作表明,宿主细胞ERK激酶通过增强肠道病毒2Apro对真核细胞翻译起始因子4G(eIF4G)的切割活性,上调病毒IRES依赖的蛋白翻译,促进病毒增殖,提示肠道病毒2Apro可能存在具有重要功能的磷酸化机制。
本研究发现:
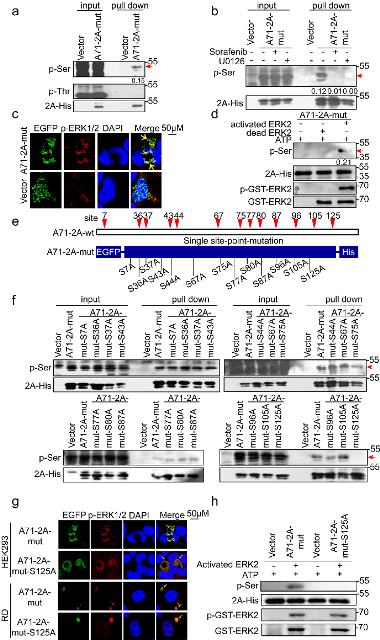
1. EV 2Apro存在丝/苏氨酸磷酸化。选用重要的肠道病毒EV-A71和CVB3为代表株,通过构建2Apro的酶活性中心催化三联体His-Asp-Cys突变的蛋白表达质粒(EV-A71 2Am和CVB3 2Am)、一系列2Am单个潜在磷酸化位点突变质粒,用His-pull down和泛磷酸化丝/苏氨酸抗体证明,EV-A71 2 Am蛋白发生了S125磷酸化,而CVB3 2 Am蛋白存在T125磷酸化。
2. 丝/苏氨酸磷酸化受细胞ERK激酶调控。进一步特异性阻断ERK激酶活性,可观察到2 Am S/T125磷酸化水平被明显抑制;激光共聚焦结果显示磷酸化ERK1/2分别与这两种2 Am蛋白存在共定位作用;此外,in vitro磷酸化实验结果显示,激活的ERK2激酶可介导EV-A71 2 Am和CVB3 2 Am S/T125体外磷酸化修饰。
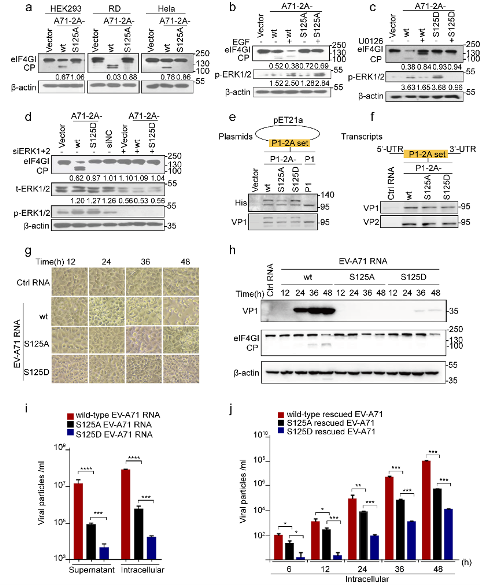
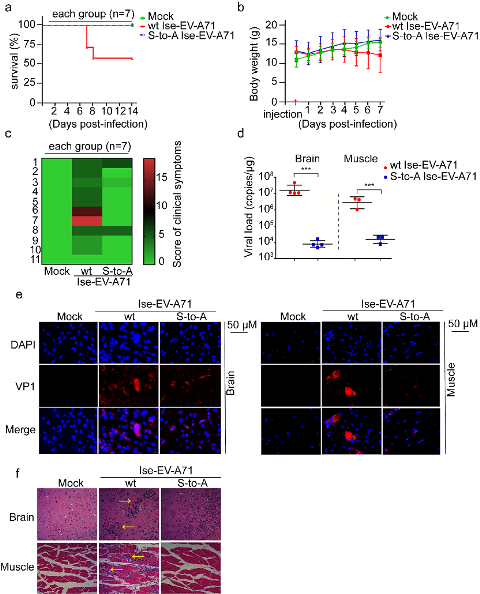
3. 模拟非磷酸化的S/T 125A,2Apro的酶活性、病毒的复制和致病性显著减弱,且该现象在肠道病毒属病毒中高度保守。采用经典的突变体功能实验表明,模拟非磷酸化的S/T 125A 2Apro对细胞eIF4G切割能力明显减弱;同样,S/T 125A病毒引起的CPE显著减弱,病毒载量下降100倍。用S125A EV-A71感染hSCARB2-KI鼠,发现小鼠的生存曲线、体重变化、临床症状、组织学病理表现和病毒载量等代表病毒增殖和致病能力的指标,与野生型病毒感染的hSCARB2-KI鼠相比显著减弱。此外,序列比对以及5种(species)代表性EV 2A S/T125A蛋白功能实验发现,S/T 125磷酸化及其功能在整个肠道病毒属的2Apro中高度保守。
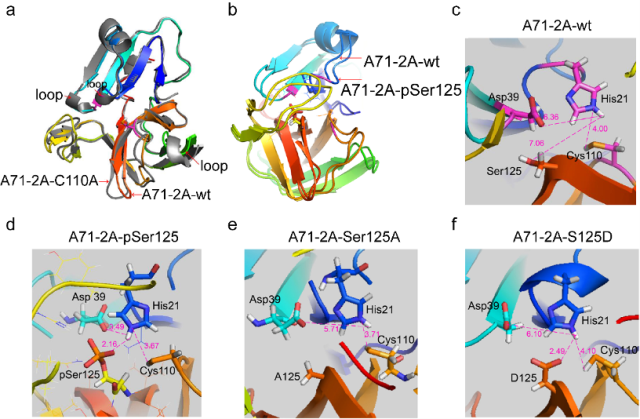
4. 基于EV-A71 2A pro 3D晶体结构的分子动力学分析发现,S125磷酸基团可与周围氨基酸残基形成有效的氢键网络,从而改变2A活性中心催化三联体His-Asp-Cys空间构象,有利于Cys的-SH执行水解底物功能。而S125A和S125D基团均不具有形成有效氢键网络的作用。由此揭示了EV-A71 2Apro S125 磷酸化修饰有益于对底物水解的分子动力学机制。
综上,本研究确立:肠道病毒存在由宿主细胞ERK1/2激酶介导的2Apro S/T125单位点磷酸化修饰作用,该位点磷酸化有益于病毒 2Apro切割活性,并有效保障肠道病毒增殖和致病作用,且该作用在肠道病毒中高度保守,体现了肠道病毒对宿主细胞的适应性。其机制是通过2A 125位点的磷酸化,来改变催化三联体His-Asp-Cys空间构象,能有效保障其执行Cys -SH底物的水解作用。此外,含有S/T125A突变的弱毒株为开发肠病毒减毒活疫苗提供了潜在的通用策略,该工作已获得国家发明专利1项(专利号:ZL 2020 1 0026635.4)。
北京大学医学部基础医学院彭宜红教授为本论文的通讯作者,基础医学院博士生王誉雅、博士研究生邹文佳为本文的共同第一作者。北京大学医学部基础医学院为第一完成单位。北京大学药学院教授徐萍教授和牛彦副教授,中国食品药品检定研究院范昌发研究员和吴勇技师,哈尔滨医科大学钟照华教授,南昌大学罗志军教授为本论文的共同作者,并为研究工作的顺利完成提供了重要支持和帮助。本研究得到了国家自然科学基金(No. 81974310 and No.81772184)、国家重点研发计划项目的资助(No. 2021YF2301700)。
(来源:病毒学界)
原文出处:Wang Y, Zou W, Niu Y, Wang S, Chen B, Xiong R, Zhang P, Luo Z, Wu Y, Fan C, Zhong Z, Xu P, Peng Y. Phosphorylation of Enteroviral 2Apro at Ser/Thr125 Benefits Its Proteolytic Activity and Viral Pathogenesis. J Med Virol. 2022 Dec 13. doi: 10.1002/jmv.28400. Epub ahead of print. PMID: 36511115.
