公共卫生学术热点追踪
复旦大学袁正宏团队利用CRISPR-Tag揭示乙型肝炎病毒共价闭合环状DNA的活细胞动力学
乙型肝炎病毒(hepatitis B virus,HBV)引起的慢性乙型肝炎(chronic hepatitis B,CHB)如未经过规范的治疗,可发展为肝硬化甚至肝癌,是严重危害人类健康的公共卫生问题。乙肝病毒的持续性感染最重要“推手”是其共价闭合环状DNA(covalent closed circular DNA,cccDNA),目前的抗病毒药物均无法靶向cccDNA将其清除。袁正宏课题组在2021年通过高灵敏荧光原位杂交(FISH)揭示了HBV 感染肝细胞的核酸动力学及细胞核内病毒cccDNA的表观遗传学特性,以“定格动画”的方式给cccDNA做了“画影图形”(PLoS Pathog. 2021 Aug 9;17(8):e1009838),但该技术无法获得cccDNA在活细胞内的时空动态信息。而本项研究第一次给cccDNA拍摄出“IMAX电影”,成为研究其活细胞动态的利器。

乙肝病毒的基因组微小(约3200碱基对),编码基因紧凑,同一段DNA序列可编码多种不同蛋白,甚至还带有很多顺式作用元件,对其进行基因工程改造,且不影响病毒复制难度极大。为实现对cccDNA的实时成像,攻关小组巧妙地结合CRISPR-Tag DNA成像技术和重组cccDNA技术,实现病毒复制无损前提下对乙肝病毒基因组的改造,使得病毒基因组DNA含有一个拷贝的CRISPR-Tag;在特定sgRNA (small guide RNA) 的引导下,可高效招募数十个融合绿色荧光蛋白的dCas9(dCas9-GFP),实现对含有CRISPR-Tag序列的cccDNA进行单拷贝精度的细胞内示踪。通过不断优化,该系统成功在细胞核内检测到cccDNA的点状信号(图1A),并利用DNA FISH和RNA FISH验证了活细胞标记的有效性和特异性(图1B)。
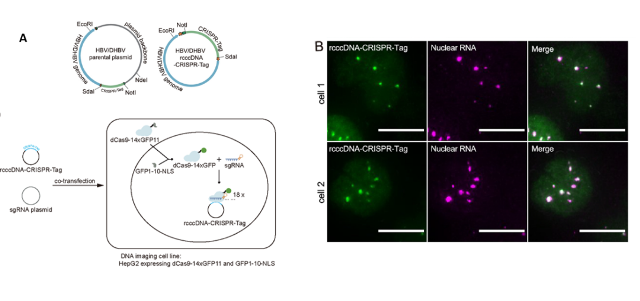
图1 HBV cccDNA活细胞成像系统的设计原理
建立cccDNA活细胞成像技术为解开乙肝病毒的一些不解之谜提供了有效的工具。研究表明,虽然cccDNA在肝细胞内较为稳定(课题组通过动物模型估测得到的半衰期约为8周 ),但在宿主细胞快速增殖条件下,病毒却无法维持在子代细胞的感染。这提示cccDNA在细胞有丝分裂后有被丢失的倾向。但囿于实验体系的限制,一直缺乏直接的证据分析cccDNA在有丝分裂前后的命运。对rcccDNA的细胞内活细胞动态观察和随后的统计学分析显示,在细胞分裂时cccDNA不黏附在染色体上,不发生扩增,大约80%的cccDNA在一轮有丝分裂过程中丢失,剩余的cccDNA被随机分配到子代细胞中(图2)。于此截然相反的是,卡波齐肉瘤疱疹病毒(Kaposi's Sarcoma-Associated Herpesvirus,KSHV)的DNA在有丝分裂过程中黏附于宿主染色体,在有丝分裂过程后大部分被保留(图3),这一现象与前人报道一致。
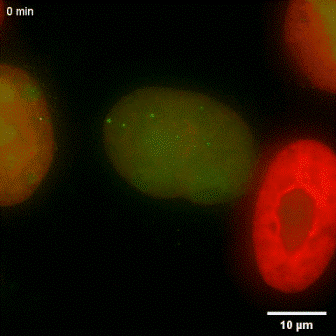
图2 rcccDNA在细胞分裂时的动态
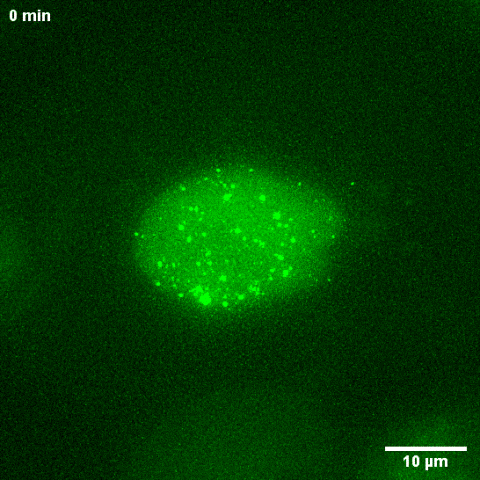
图3 KSHV来源的质粒在细胞分裂时的动态
利用该体系还获得一些意外的收获。在对rcccDNA的各种失活突变体的观察发现,在无HBx表达情况下,dCas9-GFP标记cccDNA的效率大大下降,该现象可通过外源回补HBx得以逆转(图4)。这提示HBx缺失或可降低cccDNA微染色体的可接近性,从而降低了荧光成像效率。基于此,该系统或可作为研究HBx调控cccDNA微染色体“打开”与“关闭”的有力工具。
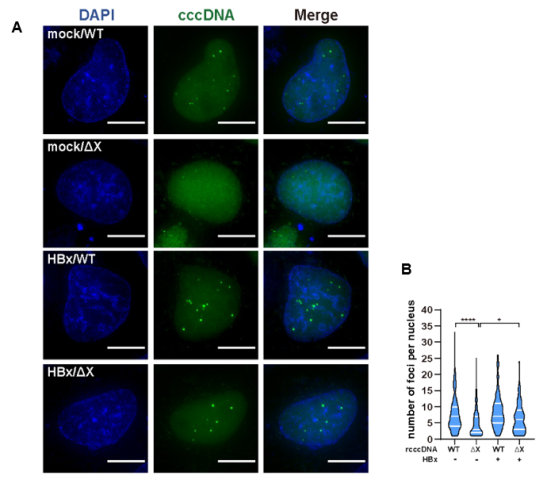
图4 HBx表达对CRISPR-Tag可及的cccDNA数量的影响。(A)HBx缺失(第二行)的rcccDNA与野生型(第一行)相比核内荧光点数明显降低,而补偿HBx表达后(第四行),光点数得以恢复。(B)荧光点数统计分析结果。
综上所述,本文构建了研究乙肝病毒cccDNA的新工具,首次实现了cccDNA的活细胞可视化和实时追踪,进一步加深了对cccDNA生物特性的认知,并为开发新的抗病毒策略和药物提供了新的理论基础和技术支撑。尤为值得关注的是cccDNA新的动态生物学特征:一轮的细胞分裂即可导致cccDNA的大量丢失,分裂后存活的cccDNA分子将随机分配到两个子代细胞中。有丝分裂后cccDNA不稳定的结果表明,如果病毒阳性细胞被抗原特异性免疫应答靶向并伴有肝细胞更新,则治愈的机会更大。此外,旨在预防HBV再感染和/或最大限度地抑制或淬灭残余病毒DNA合成和核循环的治疗方法可能会进一步加快cccDNA库的清除。
该研究得到了国家自然科学基金重大研究计划、国家科技重大专项、广东省珠江人才计划地方创新团队项目、中国医学科学院医学创新基金、上海市科委基础研究重大专项的资助。此次发表的研究论文,丁家惠为第一作者,袁正宏研究员和张小楠研究员为共同通讯作者。易志刚、宰文静、邬敏、陈宝惠和蔡启良等也为该研究做出了重要贡献。
(来源:生命科学前沿)
原文出处:Ding J, Yi Z, Zai W, Wu M, Chen B, Cai Q, Zhang X, Yuan Z. Illuminating the Live-Cell Dynamics of Hepatitis B Virus Covalently Closed Circular DNA Using the CRISPR-Tag System. mBio. 2023 Feb 22:e0355022. doi: 10.1128/mbio.03550-22. Epub ahead of print. PMID: 36840581.
