公共卫生学术热点追踪
CMI/NC/CR | 广州大学王雄军等团队合作发现改善PD-1阻断治疗的潜在新策略
肝细胞癌(HCC)的高发病率和高复发率一直是该领域的关键难题。目前可用的一线治疗药物,如酪氨酸受体激酶抑制剂lenvatinib和靶向程序性死亡-1 (PD-1)/PD-L1轴的免疫疗法,仍不足以显著提高HCC患者的5年生存率。
2023年6月7日,广州大学王雄军及中山大学刘炜共同通讯在Cellular & Molecular Immunology(IF=22)在线发表题为“Elevated nuclear PIGL disrupts the cMyc/BRD4 axis and improves PD-1 blockade therapy by dampening tumor immune evasion”的研究论文,该研究表明升高的核PIGL破坏cMyc/BRD4轴,并通过抑制肿瘤免疫逃逸改善PD-1阻断治疗。
另外,2023年5月30日,广州大学王雄军及暨南大学陆骊工团队合作在Nature Communications 发表题为“Lysyl oxidase-like 3 restrains mitochondrial ferroptosis to promote liver cancer chemoresistance by stabilizing dihydroorotate dehydrogenase”的研究论文,该研究筛选赖氨酰氧化酶(LOX)家族,以阐明其对肝癌化疗耐药性的贡献。LOXL3耗竭通过诱导铁死亡使肝癌细胞对奥沙利铂敏感。使用晚期的肝癌小鼠模型,研究进一步揭示了低剂量奥沙利铂与DHODH抑制剂来氟米特联合使用通过诱导铁死亡有效抑制肝癌进展,增加化疗敏感性并降低化疗毒性。
2023年1月16日,中国科学院上海生物化学与细胞生物学研究所杨巍维、中国科学院大连化学物理研究所李国辉、广州大学王雄军及复旦大学李全林共同通讯在Cell Research(IF=46)在线发表题为“Fructose-1,6-bisphosphatase 1 dephosphorylates IκBα and suppresses colorectal tumorigenesis”的研究论文,该研究表明果糖-1,6-二磷酸酶1去磷酸化IκBα并抑制结直肠肿瘤发生。该研究揭示了FBP1作为蛋白磷酸酶之前未被认识到的作用,并确定了FBP1介导的IκBα去磷酸化在结直肠肿瘤发生中的关键作用。

肿瘤组织中的免疫抑制环境是由趋化因子导向的促癌免疫细胞调节的,被认为是肿瘤治疗的主要障碍。例如,肿瘤组织(包括肿瘤细胞和巨噬细胞)分泌的CCL2将肿瘤相关巨噬细胞募集到肿瘤组织中。CCL20由树突状细胞、巨噬细胞或肿瘤细胞分泌,募集调节性T细胞,抵消细胞毒性T淋巴细胞的扩张和激活。上述细胞类型在肿瘤组织中产生免疫抑制微环境,促进肿瘤细胞逃避免疫监视。
cMyc控制全局基因表达,调控细胞增殖、细胞分化、细胞周期、代谢和凋亡。据研究表明,Myc,包括cMyc和nMyc,在大约70%的人类癌症中是失调的,强有力的证据表明Myc在肿瘤的发生和维持中都有异常表达。cMyc与其合作伙伴合作,例如含溴结构域(BRD)家族蛋白,以有效地调节基因表达,并特异性和稳健地上调其靶基因。BRD4和cMyc广泛结合到启动子或远端启动子中活性基因的调控区域。cMyc与BRD4的紧密性决定了一些cMyc靶基因的表达水平。然而,由于cMyc蛋白上的浅结合袋的特殊特性,cMyc被认为是一个不可药物的靶标。因此,破坏cMyc/BRD4复合体可能是延缓癌症进展的潜在策略。
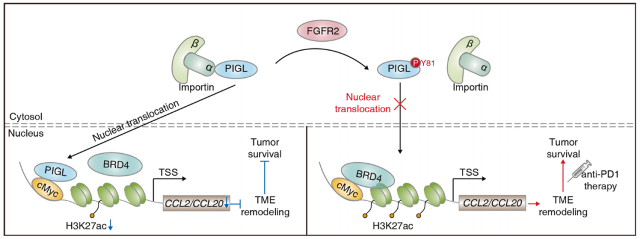
FGFR2/PIGL轴介导的CCL2/20表达决定lenvatinib + PD-1治疗效率(图源自Cellular & Molecular Immunology )
该研究发现核PIGL破坏了cMyc/ BRD4在靶基因远端启动子上的相互作用,从而降低了CCL2和CCL20的表达,而CCL2和CCL20通过募集巨噬细胞和调节性T细胞参与形成免疫抑制免疫微环境(TME)。FGFR2在Y81位点磷酸化PIGL,消除了PIGL与输入蛋白α/β1的相互作用,从而将PIGL保留在细胞质中,并通过释放CCL2和CCL20促进肿瘤逃逸。临床上,核PIGL升高预示HCC患者预后较好,且与肿瘤中CD8 +T细胞的富集呈正相关。临床上,该研究结果强调,核PIGL强度或PIGL-Y81磷酸化的变化应作为生物标志物来指导lenvatinib与PD-1阻断治疗。
(来源:iNature)
原文出处:Yu H, Shi T, Yao L, Xu D, Ding Y, Xia Q, Liu W, Wang X. Elevated nuclear PIGL disrupts the cMyc/BRD4 axis and improves PD-1 blockade therapy by dampening tumor immune evasion. Cell Mol Immunol. 2023 Jun 7. doi: 10.1038/s41423-023-01048-3. Epub ahead of print. PMID: 37280393.
