公共卫生学术热点追踪
连发3篇Science:浙江大学王宇浩等发现肠道菌群调控脂质代谢新机制
肠道菌群对哺乳动物的代谢有着重要的影响。在小鼠体内,肠道菌群可增强膳食多糖的消化,促进肠上皮细胞对膳食脂肪的吸收,并改变脂肪组织的功能。与在小鼠中发现的结果一致,人类肠道菌群组成的变化与代谢紊乱(包括肥胖、2型糖尿病和心血管疾病)相关。鉴于全球范围内代谢性疾病的发病率的迅速增加,我们迫切需要了解肠道菌群影响宿主代谢的机制。
长链非编码RNA(lncRNA)是一类不翻译为蛋白、但具有生物学功能的RNA转录本。之前的大量研究显示,lncRNA可调控细胞增殖、细胞死亡、肿瘤发生和免疫等生物学过程,但其是否参与肠道菌群对宿主代谢的调控尚不清楚。
2023年8月24日,浙江大学转化医学研究院/浙江大学医学院附属第一医院/国家基础科学中心王宇浩研究员团队联合德克萨斯大学西南医学中心Lora Hooper院士团队,在 Science 期刊发表了题为:The gut microbiota reprograms intestinal lipid metabolism through long non-coding RNA Snhg9 的研究论文[1]。
该研究首次发现,肠道菌群通过抑制小肠上皮细胞中长链非编码RNA(lncRNA)Snhg9的表达来重编程小鼠肠道的脂质代谢,确定了lncRNA在肠道菌群调控宿主代谢中的一个意想不到的作用。这些发现也为通过靶向lncRNA Snhg9和肠道菌群来治疗代谢性疾病的提供新策略。

王宇浩2012年赴德克萨斯大学西南医学中心攻读博士学位,师从美国科学院院士、肠道微生态领域领军者 Lora Hooper 教授。2017年博士毕业后,王宇浩博士继续在西南医学中心免疫学系从事博士后研究,并成为HHMI助理研究员。在此期间,王宇浩致力于探索肠道微生物和宿主间的共生关系和相互影响,先后发表了两篇 Science 论文。2020年12月,王宇浩回国加入了浙江大学医学院附属第一医院转化医学研究院、浙江大学癌症研究院。

王宇浩博士(左)、Lora Hooper教授(右)
2017年9月,Lora Hooper、王宇浩等在 Science 期刊发表了题为:The intestinal microbiota regulates body composition through NFIL3 and the circadian clock 的研究论文[2]。
该研究首次发现,肠道菌群通过昼夜节律转录因子NFIL3来调控宿主的脂质吸收和输出,这一发现为肠道微生物群如何调控身体组成提供了新见解,确立了NFIL3作为肠道微生物群、生物钟和宿主代谢之间的重要分子纽带。

2019年,Lora Hooper、王宇浩等在 Science 期刊发表了题为: The intestinal microbiota programs diurnal rhythms in host metabolism through histone deacetylase 3 的研究论文[3]。
该研究首次发现,肠道菌群通过诱导肠道上皮细胞表达组蛋白去乙酰化酶3(HDAC3)调控小鼠小肠的日间代谢节律。这一研究结果揭示了HDAC3整合肠道微生物和昼夜节律信号来调节日间代谢节律,并指出了肠道微生物群控制宿主代谢的关键机制。此外,HDAC3还直接激活雌激素相关受体α,促进脂质吸收。这也解释了为什么缺乏肠道菌群的小鼠不会在高脂饮食下肥胖。

上述两项研究揭示了肠道微生物群在调控宿主的脂质吸收和代谢中的核心作用。而在这项发表于 Science 的最新研究中,研究团队进一步研究了肠道菌群是否会影响肠道上皮细胞的lncRNA的转录,从而影响脂质代谢。
在这项研究中,研究团队发现,无菌小鼠的小肠上皮细胞中lncRNA-Snhg9转录水平显著升高。值得一提的是,lncRNA通常被定义为长度>200nt,而小鼠的lncRNA Snhg9的长度仅为183nt,但人lncRNA Snhg9长度为233nt,因此小鼠和人的lncRNA Snhg9都被归类为lncRNA。
进一步实验显示,肠道菌群通过肠道中的髓样细胞和3型固有淋巴样细胞(ILC3)间接抑制lncRNA Snhg9的表达。lncRNA Snhg9通过与SIRT1的抑制蛋白CCAR2的结合来提高SIRT1活性,而SIRT1是脂质代谢的核心调节因子PPARγ的抑制剂。因此,lncRNA Snhg9通过CCAR2-SIRT1-PPARγ信号轴来抑制脂质吸收、减少体脂,保护身体免受饮食诱导的肥胖。
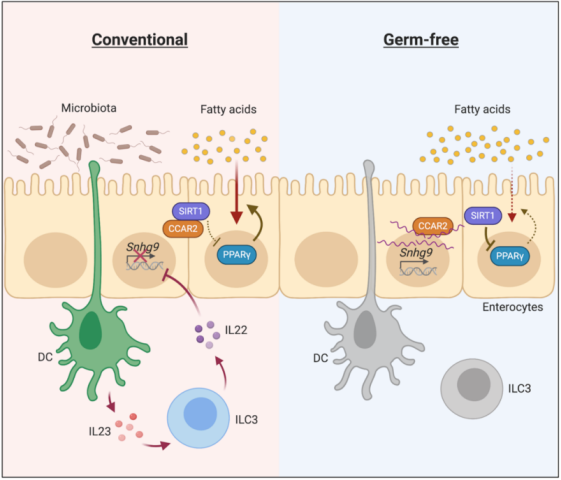
总的来说,该研究发现了lncRNA Snhg9通过将SIRT1与CCAR2解离来调控PPARγ活性,为lncRNA如何调节肠道脂质代谢提供了新见解。这些发现促进了我们对复杂的上皮细胞网络的理解,这些网络对微生物信号做出反应,调节脂质代谢。这些发现也为通过靶向lncRNA Snhg9和肠道菌群来治疗代谢性疾病的提供新策略。
(来源:生物世界)
参考文献:
[1] Wang Y, Wang M, Chen J, et al. The gut microbiota reprograms intestinal lipid metabolism through long noncoding RNA Snhg9[J]. Science. 2023 Aug 25;381(6660):851-857. doi: 10.1126/science.ade0522. Epub 2023 Aug 24. PMID: 37616368.
[2] Wang Y, Kuang Z, Yu X, et al. The intestinal microbiota regulates body composition through NFIL3 and the circadian clock[J]. Science. 2017 Sep 1;357(6354):912-916. doi: 10.1126/science.aan0677. PMID: 28860383; PMCID: PMC5702268.
[3] Kuang Z, Wang Y, Li Y, et al. The intestinal microbiota programs diurnal rhythms in host metabolism through histone deacetylase 3[J]. Science. 2019 Sep 27;365(6460):1428-1434. doi: 10.1126/science.aaw3134. PMID: 31604271; PMCID: PMC7158748.
