公共卫生学术热点追踪
Immunity | 李明团队通过重编程巨噬细胞来竞争抑制肿瘤血管生成
肿瘤组织在发展过程中往往伴随着大量新的血管生成来维持肿瘤细胞的生长和增殖[1]。与感染性的微生物疾病类似,恶性肿瘤细胞经历过度扩张,会诱发组织炎症并招募大量的免疫细胞。肿瘤相关巨噬细胞(TAM)是浸润在肿瘤微环境中数量最多的免疫细胞之一,也是促进肿瘤血管生成和形成免疫抑制性微环境的重要角色。在组织损伤中,巨噬细胞会经历从促炎到抗炎的状态,帮助组织恢复稳态;而肿瘤特殊的免疫抑制性的微环境会使巨噬细胞的功能发生改变,无法有效地修复损伤的组织,肿瘤从而形成了一个“无法愈合的伤口”[2]。因此,能否通过改变肿瘤相关巨噬细胞的状态来影响肿瘤血管生成和组织修复成为了一个十分有意思的问题。
2023年11月14日,来自于美国纪念斯隆凯特琳癌症中心李明团队的Mytrang Do,石玮(现在单位:北京脑科学与类脑研究所),吉亮亮和合作者在Immunity上发表了题为Reprogramming Tumor-Associated Macrophages to Outcompete Endovascular Endothelial Progenitor Cells and Suppress Tumor Neoangiogenesis的研究论文,发现了可以通过代谢重编程肿瘤相关巨噬细胞来抑制肿瘤组织中的血管生成,从而抑制肿瘤的生长。

巨噬细胞具有极强的可塑性,其细胞状态可以随着微环境的变化而发生改变。而肿瘤微环境的复杂和多变导致肿瘤相关巨噬细胞的状态具有很高的异质性。肿瘤组织从空间角度来说可以分为实质(parenchyma)和间质(interstitial)。与之对应,位于其中的巨噬细胞可以分为肿瘤实质巨噬细胞(以下简称为TAM)和间质巨噬细胞(以下简称为MTM)[3]。在这篇文章中,研究人员利用MMTV-PyMT乳腺癌转基因小鼠模型,发现肿瘤中的TAM的大小和mTORC1信号强度显著地小于MTM,这个现象跟它们之间的环境差异紧密相关。mTORC1通过TSC(tuberous sclerosis complex)复合物感知环境中的生长因子、氧气和能量信号[4]。为了探索TAMs中低mTORC1活性是否归因于TSC复合物,研究人员在PyMT转基因乳腺癌小鼠中敲除TAM中TSC复合物中的Tsc1。结果发现Tsc1敲除的TAM细胞大小和mTORC1信号强度显著升高。更加令人兴奋的是Tsc1缺失的TAM能有效地抑制肿瘤生长。
为了进一步探究Tsc1缺失的TAM如何抑制肿瘤生长,研究人员首先通过遗传实验排除了获得性免疫细胞的作用。因为在获得性免疫细胞缺失的小鼠(Rag1敲除)背景中,Tsc1缺失的TAM依旧可以抑制肿瘤生长。于是研究人员将注意力集中在了TAM本身上。通过荧光成像的方式,研究人员惊奇地发现Tsc1缺失的TAM在肿瘤中的位置发生了显著的改变:野生型的TAM在肿瘤实质中均匀的分布,而Tsc1缺失的TAM更加靠近肿瘤中的血管。除此之外,研究人员还发现Tsc1缺失的TAM可以重塑肿瘤中血管的结构,抑制血管的新生,使得远离血管的肿瘤细胞大面积坏死。更有意思的是,Tsc1缺失的TAM与血管内皮细胞紧密结合,而大部分与Tsc1缺失的TAM接触的PROCR阳性的肿瘤内皮祖(干)细胞都会进行凋亡(图1)。
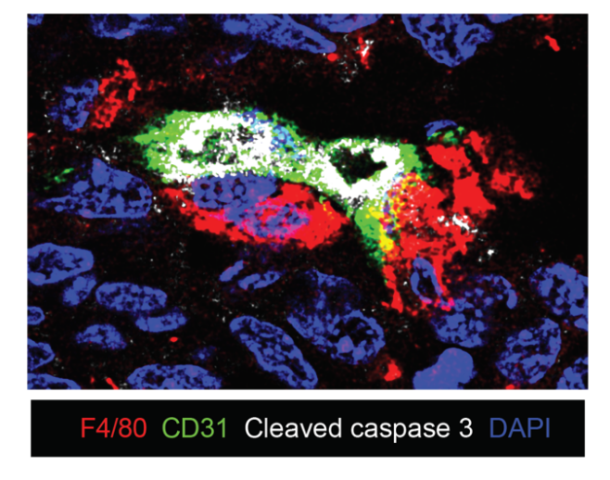
图1注:Tsc1缺失的肿瘤相关巨噬细胞与肿瘤内皮细胞相互作用导致内皮细胞凋亡
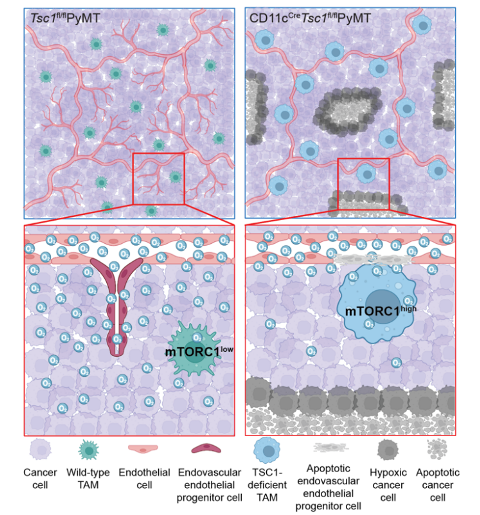
为了探究Tsc1缺失的TAM为何会展现出这些表型,研究人员通过单细胞转录组测序技术发现Tsc1缺失的TAM的溶酶体生成和细胞代谢水平显著上升。后续的功能性实验也证明Tsc1缺失的TAM具有更强的吞噬能力,而且它们的线粒体呼吸水平上调尤为明显。于是,研究人员认为,由于Tsc1缺失的TAM具有很强的mTORC1活性和线粒体氧化磷酸化能力,它们需要获得更多地养分来维持生长,所以它们只能存活在靠近血管、养分充足的位置。而它们这种空间位置的改变导致其与血管内皮细胞产生了竞争,在这种情况下,Tsc1缺失的TAM成为了胜者。因此,在这项工作中,研究人员通过代谢重编程TAM来改变其在肿瘤中的状态和位置,使其从促进肿瘤血管生长变为竞争抑制血管生成,从而导致肿瘤细胞死亡(图2)。这项工作为肿瘤的免疫疗法提供了崭新的思路,即通过改变免疫细胞的状态来重塑肿瘤微环境,从组织维度把肿瘤这个“不可愈合的伤口”进行修复。
(来源:BioArt)
参考文献:
1. Bergers, G., and Benjamin, L.E. (2003). Tumorigenesis and the angiogenic switch. Nature reviews. Cancer 3, 401-410. 10.1038/nrc1093.
2. Dvorak, H.F. (1986). Tumors: wounds that do not heal. Similarities between tumor stroma generation and wound healing. N Engl J Med 315, 1650-1659. 10.1056/NEJM198612253152606.
3. Zhang, X., Ji, L., and Li, M.O. (2023). Control of tumor-associated macrophage responses by nutrient acquisition and metabolism. Immunity 56, 14-31. 10.1016/j.immuni.2022.12.003.
4. Saxton, R.A., and Sabatini, D.M. (2017). mTOR Signaling in Growth, Metabolism, and Disease. Cell 169, 361-371. 10.1016/j.cell.2017.03.035.
