公共卫生学术热点追踪
Nat Aging | 上海科技大学周智等团队合作揭示溶酶体功能缺陷对睾丸衰老的调控机制
与年龄相关的睾丸功能变化会影响健康和幸福。与年龄相关的睾丸功能障碍的机制,如迟发性性腺功能减退(LOH),仍然不完全清楚。
2024年4月22日,上海科技大学周智、上海交通大学李铮及中国科学院上海高等研究院王晨琛共同通讯(邓植文、李莎及赵亮宇为本文共同第一作者)在Nature Aging 在线发表题为“Targeting dysregulated phago-/autolysosomes in Sertoli cells to ameliorate late-onset hypogonadism”的研究论文,该研究发现靶向支持细胞中失调的吞噬/自溶酶体以改善迟发性性腺功能减退。通过对患有LOH的人睾丸进行单细胞RNA测序,研究发现支持细胞(SCs)在睾丸微环境中是关键的代谢协调者。特别是,溶酶体酸度探测显示衰老SCs的降解能力受损,阻碍了自噬和吞噬通量。
SCs积累代谢产物,包括胆固醇,并增加炎症基因表达;因此,该研究将这些细胞称为吞噬/自溶酶体失调的SCs。暴露于高脂肪饮食诱导的吞噬细胞/自身溶酶体失调样SCs,再现小鼠LOH特征。值得注意的是,在高脂肪饮食诱导的LOH小鼠中,传出小管注射和全身TRPML1激动剂可恢复溶酶体功能,使睾酮缺乏和相关异常正常化。该研究结果强调了SCs在睾丸衰老中的核心作用,为LOH提供了一条有希望的治疗途径。

睾丸通过分泌睾酮来协调和帮助维持大脑、肌肉和其他器官的功能平衡。年龄相关的病理性睾丸退化可导致性腺功能减退,原发性睾丸功能衰竭是其最常见的原因。最近对衰老的人类睾丸的描述揭示了明显的体细胞变性,这表明睾丸微环境(TME)稳态的不平衡可能是破坏睾丸功能的罪魁祸首。SCs在生育中起着至关重要的作用,是睾丸中主要的支持细胞。
即使在成年期,SCs的基因消融也强调了它们的重要性,导致精子发生完全消失,间质细胞(LC)数量减少80%。在脂质代谢中,脂质作为SCs的燃料,对发育中的生殖细胞的膜重塑或LCs的睾酮产生至关重要。SCs中的脂质代谢或外排调节因子的缺失可导致脂质积累和睾丸胆固醇稳态受损。尽管有这些研究,SCs的变化如何导致睾丸衰老和相关疾病(如LOH)仍不清楚。
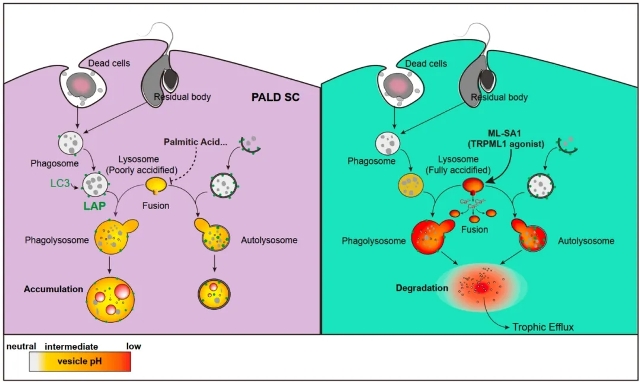
示意图左侧显示Phago-/auto- dysregulated (PALD) SC中溶酶体酸度异常导致代谢物累积;右侧通过改善溶酶体功能恢SC的代谢和营养支持功能
LOH是一种以睾酮缺乏(TD)为主要特征的多因素睾丸疾病。流行病学研究表明,长期TD不仅会对患者的生活质量产生不利影响,还会增加各种代谢综合征和退行性疾病的风险,包括糖尿病、动脉硬化、痴呆和全因死亡率。至少2-6%的40岁以上男性患有症状性性腺功能减退(性功能障碍、疲劳和耐力差),其严格的生化特征是总睾酮(TT)水平急剧下降(LOH <3.2 ng ml -1)。LOH的主要非遗传风险因素包括某些生活习惯(高热量饮食、烟草和酒精)、年龄和感染。例如,饮食性肥胖(DIO)是一个全球性挑战,也是LOH的最强危险因素之一。然而,关于这些因素如何导致LOH患者睾丸功能障碍的综合分析很少。
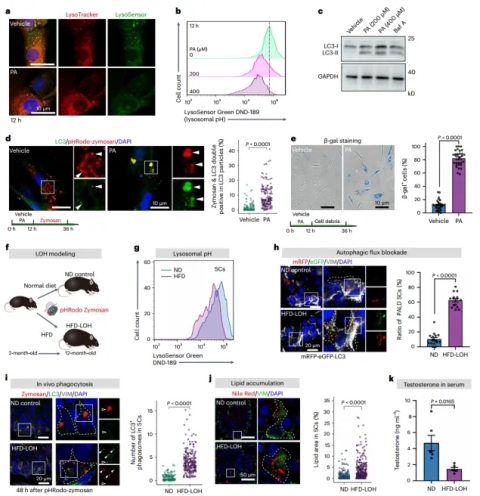
HFD应激加速了PALD样SCs和LOH表型的出现(图源自Nature Aging )
目前可用于症状性LOH的干预措施包括姑息性睾酮替代疗法(TRT)。由于可能产生严重的副作用,如不孕和心血管疾病,这种方法在临床应用中受到限制。然而,忽视LOH状况可能导致其他慢性疾病;早期研究表明,TME中的各种细胞,包括SCs,可以通过旁分泌因子影响LCs中T的形成,这表明TME需要精细的调节。因此,系统地分析LOH患者的TME可能为减轻这些个体的睾丸内在功能提供新的见解。
该研究利用多种技术揭示了吞噬/自溶酶体失调(PALD) SCs作为睾丸衰老的指标和SC功能障碍的加速器的作用。具体来说,PALD SCs与炎症基因表达和脂质积累(例如胆固醇)有关。衰老SCs中溶酶体酸度受损导致自噬和吞噬流效率低下,导致代谢物积累。此外,饮食应激,例如过量的饱和脂肪酸(棕榈酸(PA)),直接加速了SCs向PALD SCs的转化。值得注意的是,通过使用TRPML1激动剂增强溶酶体降解活性,成功地减轻了高脂肪饮食(HFD)喂养的老年小鼠的LOH,为治疗睾丸衰老疾病(包括LOH)提供了潜在的治疗策略。
(来源:iNature)
原文出处:Deng Z, Zhao L, Li S, Chen X, Ling X, Zheng J, Yu K, Xu J, Yao C, Han S, Liang J, Feng H, Wu L, Li P, Tian R, Jing T, Tang Y, Dai Y, Yan M, Wang C, Li Z, Zhou Z. Targeting dysregulated phago-/auto-lysosomes in Sertoli cells to ameliorate late-onset hypogonadism. Nat Aging. 2024 Apr 22. doi: 10.1038/s43587-024-00614-2. Epub ahead of print. PMID: 38649614.
