公共卫生学术热点追踪
《细胞发现》:幽门螺杆菌后继有菌!中国科学家揭秘咽峡炎链球菌促胃癌的新机制,可改变肿瘤免疫微环境,抑制T细胞助力癌细胞
提起促胃癌的微生物,大家肯定第一个想到幽门螺杆菌(Hp)。不过其实胃癌的风险因素也很多,“胃癌菌”肯定也不止这一个。
今年2月,香港中文大学于君等团队在《细胞》杂志发文,首次指出咽峡炎链球菌(SA)也是促胃癌的幕后黑手,其作用可能不亚于幽门螺杆菌。
今日,《细胞发现》杂志发表了来自浙江省肿瘤医院、复旦大学、中国科学院杭州医学研究所、贝克曼研究所等团队的研究成果,研究者们发现,胃癌组织中的咽峡炎链球菌丰度与预后呈显著负相关,咽峡炎链球菌可通过精氨酸代谢通路重塑肿瘤免疫微环境,促进癌细胞增殖和转移的同时,还会抑制CD8+T细胞的分化和浸润。
咽峡炎链球菌的存在会加速胃癌的发生和发展,抗生素治疗则能有效改善咽峡炎链球菌的负面影响。

论文题图
胃癌(GC)的主要风险因素包括年龄、高盐摄入、水果和蔬菜低摄入、幽门螺杆菌感染。不过其实大家也不用对幽门螺杆菌那么谈之色变,尽管过半人口都感染了幽门螺杆菌,但发展到胃癌的可能性也不过百之一二。
与此同时,科学家们也发现,胃中含有丰富的微生物群,其中很可能还有其他能够像幽门螺杆菌一样影响胃癌进展的菌群。
研究者们收集了609份来自胃癌患者的组织样本,包括290个肿瘤样本和319个肿瘤相邻正常组织样本。对这些组织样本进行16S rRNA测序,并根据测序结果的微生物组特征进行分组,研究者发现肿瘤样本能够被分为6个亚型,并且这个分组是独立于患者临床特征的胃癌预后因素。
在6个亚组中,研究者发现有3组中存在特定菌群的显著富集:第2组中的幽门螺杆菌(占84.06%)、第3组中的假单胞菌(占47.93%)、第4组中的链球菌(占19.08%)。
更值得关注的是,第3组和第4组患者相较其他组的生存显著更差。这两组可以观察到肿瘤组织中抗肿瘤CD8+T细胞耗竭、肿瘤耐药/逃逸相关M2巨噬细胞数量增加。
显然,存在特定的菌群参与肿瘤的发展。
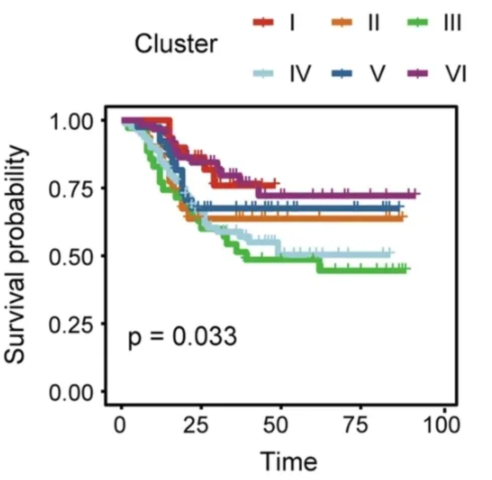
微生物特征与预后显著相关
研究者对特定组的微生物组成进行了分析,并与其他研究结果进行了对照,最终认为咽峡炎链球菌与胃癌进展有着莫大的关系。在食管癌和结直肠癌组织样本中并未观察到咽峡炎链球菌水平的异常,可见它是胃癌独有的风险因素。
分析结果可见,咽峡炎链球菌水平与患者预后、瘤内CD8+T细胞水平呈负相关。
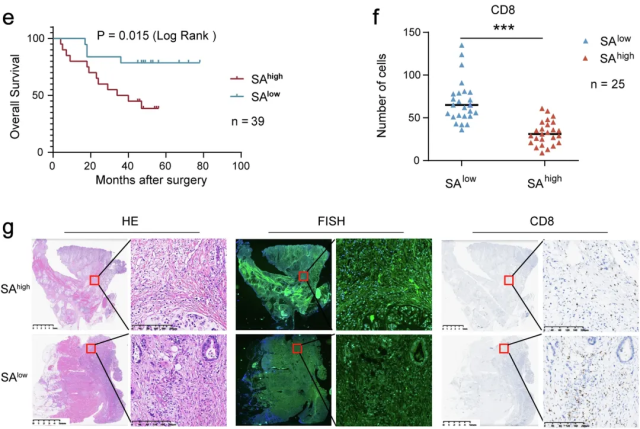
SA是胃癌的独立预后因素
研究者在小鼠中进行了实验。使用N-甲基亚硝基脲(MNU)诱导的自发性胃癌肿瘤形成率约为36.36%,但在同时给小鼠移植咽峡炎链球菌后,肿瘤形成率暴涨到80%,是原本的2倍还多。
咽峡炎链球菌会显著促进肿瘤的增殖,SA组小鼠的肿瘤体积更大。免疫组化结果显示,SA组中CD8+T细胞数量显著降低,同时指示增殖的Ki-67、指示侵袭和转移的N-钙黏蛋白和波形蛋白的水平升高。
这说明咽峡炎链球菌一手加强癌细胞、一手抑制T细胞,真是双管齐下、不留死角。不过我们用抗生素就能对付它,抗生素治疗可以显著逆转咽峡炎链球菌的促癌效果。
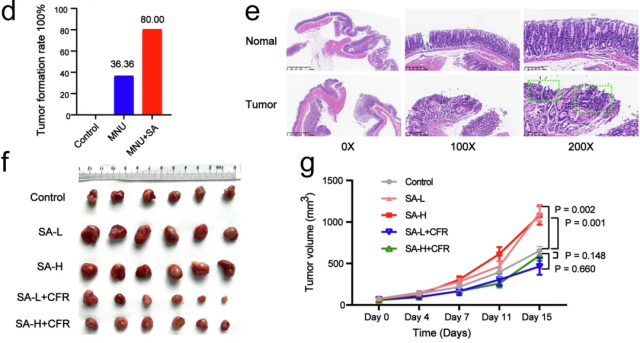
SA会促进胃癌进展,抗生素治疗可逆转这一作用
咽峡炎链球菌到底做了什么?
研究者对相关代谢途径进行了分析,发现氨基酸代谢表现出了最多的差异。咽峡炎链球菌可以代谢精氨酸产生鸟氨酸,而鸟氨酸则有着调节肿瘤免疫微环境、导致肿瘤免疫逃逸和进展的作用。
在胃癌患者组织样本中,研究者也发现,咽峡炎链球菌阳性的肿瘤样本中精氨酸水平显著降低、鸟氨酸水平增加。
看来这就是咽峡炎链球菌的作恶手段了。
大量研究表明,微生物群可以通过代谢途径的改变与宿主建立免疫-微生物-代谢轴,从而参与宿主的免疫代谢调节。本文的发现揭示了胃癌中不同瘤内微生物特征的预后和临床意义,并揪住了咽峡炎链球菌这个有潜力的胃癌治疗新靶点。
(来源:奇点网)
原文出处:Yuan L, Pan L, Wang Y, Zhao J, Fang L, Zhou Y, Xia R, Ma Y, Jiang Z, Xu Z, Hu C, Wang Y, Zhang S, Zhang B, Ding H, Chen M, Cheng H, Goel A, Zhang Z, Cheng X. Characterization of the landscape of the intratumoral microbiota reveals that Streptococcus anginosus increases the risk of gastric cancer initiation and progression. Cell Discov. 2024 Nov 26;10(1):117. doi: 10.1038/s41421-024-00746-0. PMID: 39587089; PMCID: PMC11589709.
