公共卫生学术热点追踪
预防癌症要从年轻做起!《自然》揭秘:老了以后,患癌风险为何降低了?
癌症发生与年龄有着怎样的联系?根据美国国立卫生研究院的统计数据,低于20岁的人群中,每10万人中的癌症病例低于25人;而到了60岁至84岁,每10万人中的癌症病例可达到1000人以上。
这种现象其实并不难理解,个体年龄越大,就代表着体内会累积更多的体细胞突变,尤其是成体干细胞与祖细胞中累积过多突变,会显著提升癌症发生的可能性。此外,身体中长期存在的慢性炎症也会助力细胞发生癌变。
看到这里,你可能觉得年龄越大,癌症风险只会越来越高。但是更多的研究也发现,长寿与癌症并非两者只能选其一。从动物的视角,一些寿命较长的物种的患癌率并不如人类,而来自人类的临床数据也显示, 85岁以上群体的患癌率相比于75-84岁是在下降的。这又是怎么一回事呢?
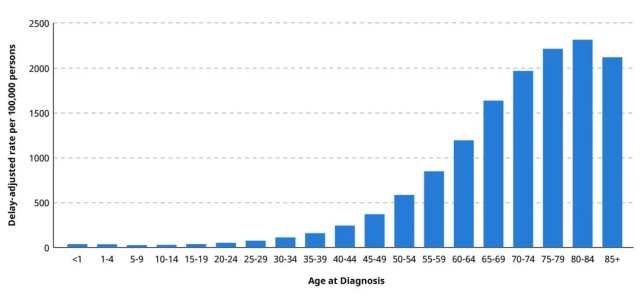
▲癌症发生率与年龄变化关系(图片来源:National Cancer Institute)
来自《自然》的一项新研究给出了一种可能性:个体的年龄增大时,干细胞、祖细胞的数量与健康状态在不断下降,而这种具有干性(stemness)的细胞是肿瘤起始所需的。这种变化打破了体细胞突变累积一直占上风的情况,因此降低了癌症发生风险。研究者指出,新发现也表明早期预防和干预癌症非常关键,年轻时发生的一些促癌行为,例如吸烟、紫外线暴露和接触致癌物质,带来的癌症风险要比年老时大得多。

研究中,作者选取了两批不同年龄的小鼠开展实验,包括鼠龄12-16周的年轻小鼠,以及鼠龄104-130周的老年小鼠。他们通过特定的腺病毒载体在小鼠的AT2细胞中引入了癌症突变,该细胞是一类位于肺泡结构中的干细胞,它既能帮助组织再生,也与肺腺癌的发生密切相关。
根据对小鼠的观察结果,在进行肿瘤激活处理后,老年小鼠的中位生存期比年轻小鼠延长了约37%。另外,老年小鼠体内的肿瘤数量更少,肿瘤负荷也要小于年轻小鼠,肿瘤体积要减少40%~60%。这说明衰老对肿瘤起始具有一定的抑制作用。
论文指出,肿瘤起始对相关组织中细胞的自我更新以及分化能力,即干性的要求很高。但相较于年轻小鼠,老年小鼠体内AT2细胞密度减少了约47%。而肺部损伤实验显示,AT2细胞的增殖能力、肺泡再生能力都大幅下降。从数量和质量上,AT2细胞支持肿瘤发生的可能性在衰老小鼠中已经降低了。
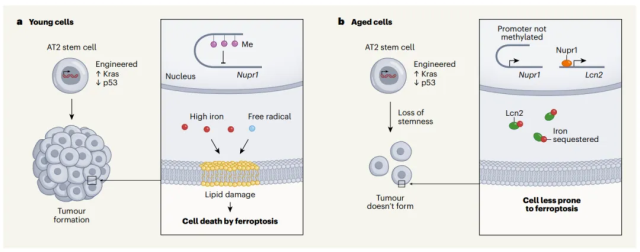
▲细胞干性的丢失,会使得肿瘤起始更加困难(图片来源:参考资料[2])
但为何AT2细胞的干性会丢失呢?作者发现了一些细微的线索:AT2的铁敏感度出现了问题。来自老年小鼠的AT2细胞中,一个名为Nupr1的蛋白会高度表达,该蛋白原本会通过激活下游特定的基因来调控细胞内铁的水平。作者解释道,当Nurp1过高时细胞对铁水平的判断会出现异常,它们会始终认为细胞没有足够的铁,从而降低细胞的干性。如果在老年小鼠中抑制Nupr1,肿瘤又会恢复起始和生长能力。
这项发现给不同疾病的治疗带来全新的思路,一类是以铁死亡为代表的新型癌症治疗策略,由于老年个体的细胞对铁感知出现异常,可能会使得该类型疗法更适合年轻个体。而对于一些肺炎或者肺损伤疾病,通过恢复细胞的铁感知或者人为提升铁水平,或许能加速损伤恢复,帮助痊愈。
(来源:学术经纬)
参考文献:
[1] Zhuang, X., Wang, Q., Joost, S. et al. Ageing limits stemness and tumorigenesis by reprogramming iron homeostasis. Nature (2024). https://doi.org/10.1038/s41586-024-08285-0
[2] Ageing stem cells are less prone to forming tumours. Retrieved December 5, 2024 from https://doi.org/10.1038/d41586-024-03721-7
