公共卫生学术热点追踪
Nat Commun 丨杨雨荷/张林琦/李太生团队揭示抗体多价结合模式与中和新机制,助力疫苗与抗体药物研发
严重急性呼吸综合征冠状病毒通过基因组突变不断进化。最新出现的奥密克戎(Omicron)变异株具有更强的传播性、感染性和免疫逃逸能力[1,2]。目前,大多数针对新冠病毒的特异性单克隆抗体(mAbs),包括已获FDA批准的抗体,对Omicron变异株的效果显著下降,接近完全失效[3, 4, 5, 6]。抗体结合表位的研究对于解释抗体析抗体中和效力和广度以及设计单抗药物至关重要,然而,目前针对抗体和刺突蛋白(S)复合物的结构研究主要关注单个抗原结合片段(Fab)的结合位点。全长的免疫球蛋白G(IgG)在生物体内的形式与Fab相比,具有更高的生物相关性。在膜结合的免疫球蛋白(mIg,即B细胞受体BCR)和分泌型免疫球蛋白(sIg)中,IgG均以Y形结构存在[7,8,9],并展示出更高的结合力及中和能力[10,11,12,13]。此外,在Fab与S蛋白结合的表位信息基础上,IgG还展示两个Fab臂与S三聚体的高阶多价结合模式。因此,深入研究全长IgG的结构及其机制,对于理解抗体功能至关重要。
近日,国家纳米科学中心杨雨荷研究员团队,清华大学医学院张林琦教授团队联合北京协和医院感染内科李太生教授团队,在Nature Communications发表了题为:Exploring Distinct Modes of Inter-Spike Cross-Linking for Enhanced Neutralization by SARS-CoV-2 Antibodies的研究论文。该研究通过分析抗体的结合亲和力、中和活性与其在冠状病毒上的高阶交联模式之间的关系,揭示了除表位结合亲和力之外,抗体与S蛋白的不同结合模式也会显著影响其中和能力。这一发现为理解抗体中和机制提供了新的视角,同时可能对新型冠状病毒的疫苗开发和抗体药物设计具有重要意义。

前期发表在Immunity期刊的一篇题为Dissecting the intricacies of human antibody responses to SARS-CoV-1 and SARS-CoV-2 infection的研究中[14],清华大学医学院张林琦教授团队、北京协和医院感染内科李太生教授团队联合国家纳米科学中心杨雨荷研究员团队从SARS患者中分离出60种针对冠状病毒受体结合域(RBD)的单克隆抗体(mAbs),并根据表位的不同将其划分为七大类(RBD-1到RBD-7)。其中,RBD-5类抗体中的一种名为W328-6H2(6H2)的抗体对野生型毒株(WT)表现出最强的中和能力,但对BA.1的中和能力却完全丧失(图一a),同时,抗体结合能力相较其他变异株(包括WT、Alpha、Beta、Gamma和Delta)相似(图一a)。为进一步研究导致6H2 IgG对BA.1毒株完全丧失中和能力的原因,该团队利用冷冻电镜(cryo-EM)解析了IgG与SARS、WT和BA.1 S蛋白的复合物结构(图1b)。研究发现,6H2 IgG与WT S结合时,会形成中心对称的交联结构,其中三个IgG分子同时交联两个S三聚体,每个IgG分别结合不同的S三聚体的两个向“下”的RBD。然而,与BA.1 S结合时,6H2 IgG形成了一种特殊的偏移中心的交联结构,其中两个IgG分别交联来自不同S三聚体的一个向“下”的RBD(RBD-2或3')和一个向“上”的RBD(RBD-2'或3)(图一b)。此外,两个S的第三个RBD未参与交联,其中一个仅与6H2 IgG的单个Fab结合,另一个则未结合。研究团队认为,这种特定的二聚体-三聚体结合模式可能对抗体的中和能力产生附加影响。
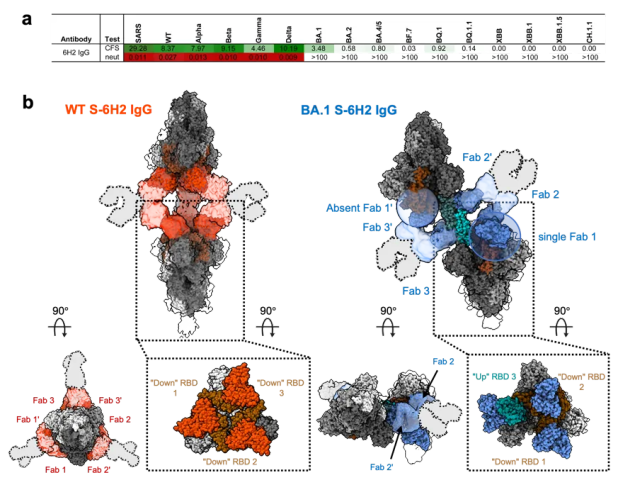
图一:W328-6H2 (6H2) IgG的结合及中和能力以及冷冻电镜结构揭示了和WT或BA.1 S形成的不同的二聚体-三聚体结构
为了进一步研究抗体结合模式对中和能力的影响,该团队设计了两组突变:1)表位突变,包括三个单点突变(G339D、N440K和G446S)以及三点组合突变(G339D-N440K-G446S,WT-M,图二a);2)构象突变,即之前研究证明会使BA.1 S的一个RBD“上”构象不稳定化的三点突变(L371S-P373S-F375S,BA.1-M,图二 c)[15]。中和实验结果显示,WT-S的表位突变会导致中和能力(IC50值)有所下降,但并未完全丧失(图二 b)。且在WT上的表位突变并未改变6H2 IgG与 S形成的中心交联结构(图二 e)。然而,在BA.1 S上的构象突变成功使抗体恢复了100%的中和能力(图二 d)。此外,BA.1-M S-6H2 IgG复合物的结合模式发生了明显变化,主要以中心交联模式为主(图二 e)。这些实验结果表明,表位突变并不是影响中和能力的唯一因素,抗体的结合模式对于中和能力的恢复同样具有关键作用。

图二:抗体和S间不同的结合模式影响了 6H2 IgG 的中和能力
该团队进一步研究了S-6H2 IgG复合物与血管紧张素转化酶2(ACE2)的结合情况。实验表明,当ACE2与预先形成的WT S-6H2 IgG复合物混合时,仍然可以观察到WT S-6H2的中心交联结构(图2a)。这表明,6H2的三个IgG分子能够完全交联WT S的六个RBD,将其稳定锁定在“下”构象中,从而形成对称且稳定中心交联模式,有效阻止了ACE2的结合。相比之下,当ACE2加入到预先形成的BA.1 S-6H2 IgG复合物中时,两个ACE2单体分别结合到此前未结合的RBD 1'和单价结合的RBD 1上(图三b)。由于ACE2能够取代结合亲和力较低的单价IgG,这种不稳定的偏移中心的交联结构为ACE2的结合提供了可能性(图三c)。
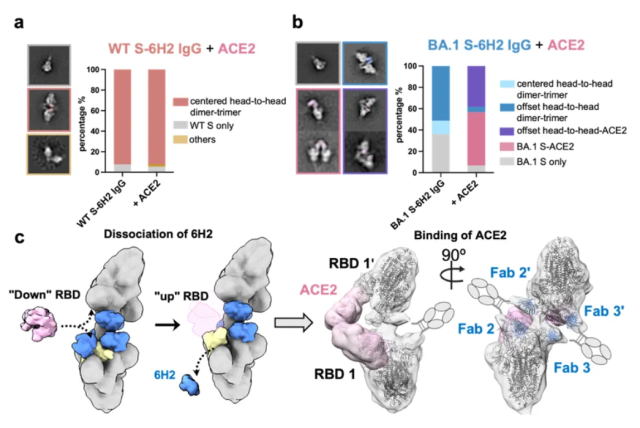
图三:负染电镜结构揭示了ACE2和预先结合形成的WT S-6H2 IgG或BA.1 S-6H2 IgG复合物形成的二聚体-三聚体结构
此外,该团队还设计了一种模型系统,用于模拟新冠病毒。该模型使用了100纳米单分散的Streptactin (链霉亲和素变体) 涂层聚苯乙烯(PS)微球,并将这些微球与新冠病毒刺突蛋白偶联(图四a)。在用较低浓度的抗体(0.005 µg/mL)与微球共孵育时,WT和BA.1微球均未表现出明显的聚集现象。然而,当抗体浓度升高至0.027 µg/mL(对应6H2 IgG对WT的IC50值)时,在WT-微球-6H2 IgG复合物中观察到显著的聚集现象;相比之下,BA.1-微球-6H2 IgG复合物仅表现出极少量的聚集。此外,在BA.1 S蛋白上设计并引入三点突变以促进构象变化为中心交联模式的BA.1-M突变株也表现出与WT类似的聚集模式(图四b)。该结果证明,高度稳定的中心交联模式能够显著促进病毒颗粒的聚集,从而增强抗体的中和效果。
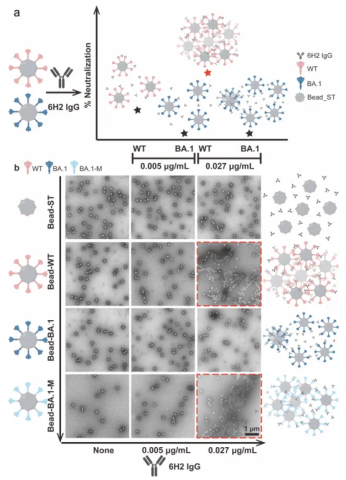
图四:通过6H2 IgG的S间交联作用引起的S蛋白修饰微球的聚集
综上所述,该研究强调除了RBD与Fab表位之间的结合亲和力外,IgG与S的多价结合模式在影响抗体亲和力和中和能力方面的补充作用。这些发现对设计新的治疗性抗体和疫苗具有重要意义。
该工作由国家纳米科学中心杨雨荷研究员团队,清华大学医学院张林琦教授团队联合北京协和医院感染内科李太生教授团队合作完成,杨雨荷研究员,张林琦教授和李太生教授为该论文的通讯作者。国家纳米科学中心联合培养博士生南轩雨,清华大学化学系博士生(已毕业),李宇杰清华大学八年制医学实验班张睿,清华大学博士后(已出站)王若珂及国家纳米科学中心联合培养博士生吕念念为本论文共同第一作者。
(来源:BioArtMED)
参考文献:
1. McCallum, M. et al. Structural basis of SARS-CoV-2 Omicron immune evasion and receptor engagement. Science 375, 864-868 (2022).
2. Cui, Z. et al. Structural and functional characterizations of infectivity and immune evasion of SARS-CoV-2 Omicron. Cell 185, 860-871 (2022).
3. Cao, Y. et al. Omicron escapes the majority of existing SARS-CoV-2 neutralizing antibodies. Nature 602, 657-663 (2022).
4. Cao, Y. et al. BA.2.12.1, BA.4 and BA.5 escape antibodies elicited by Omicron infection. Nature 608, 593-602 (2022).
5. Wang, Q. et al. Antibody evasion by SARS-CoV-2 Omicron subvariants BA.2.12.1, BA.4 and BA.5. Nature 608, 603-608 (2022).
6. Liu, L. et al. Striking antibody evasion manifested by the Omicron variant of SARS-CoV-2. Nature 602, 676-681 (2022).
7. Ma, X. et al. Cryo-EM structures of two human B cell receptor isotypes. Science 377, 880-885 (2022).
8. Su, Q. et al. Cryo-EM structure of the human IgM B cell receptor. Science 377, 875-880 (2022).
9. Dong, Y. et al. Structural principles of B cell antigen receptor assembly. Nature 612, 156-161 (2022).
10. Liu, H. et al. Cross-Neutralization of a SARS-CoV-2 Antibody to a Functionally Conserved Site Is Mediated by Avidity. Immunity 53, 1272-1280 (2020).
11. Barnes, C.O. et al. Structures of Human Antibodies Bound to SARS-CoV-2 Spike Reveal Common Epitopes and Recurrent Features of Antibodies. Cell 182, 828-842 (2020).
12. Pinto, D. et al. Cross-neutralization of SARS-CoV-2 by a human monoclonal SARS-CoV antibody. Nature 583, 290-295 (2020).
13. Liu, L. et al. Antibodies that neutralize all current SARS-CoV-2 variants of concern by conformational locking. bioRxiv, 2023.2004.2008.536123 (2023).
14. Wang, R. et al. Dissecting the intricacies of human antibody responses to SARS-CoV-1 and SARS-CoV-2 infection. Immunity 56, 2635-2649 (2023).
15. Zhao, Z. et al. Omicron SARS-CoV-2 mutations stabilize spike up-RBD conformation and lead to a non-RBM-binding monoclonal antibody escape. Nat. Commun.13, 4958-4970 (2022).
16. Yang, Y.R. et al. Immune memory shapes human polyclonal antibody responses to H2N2 vaccination. Cell Reports 43, 114171-114193 (2024).
