公共卫生学术热点追踪
激活铁死亡,促进脂肪代谢!《细胞》子刊研究或带来“轻便”减肥法
2012年,美国哥伦比亚大学Brent Stockwell教授和同事在《细胞》杂志发表了一项重磅论文,他们开创性地提出了铁死亡(ferroptosis)一词。与过去所发现的凋亡、自噬或坏死都不同,这类细胞死亡方式主要由铁与活性氧介导的细胞膜脂质过氧化诱导,可导致细胞功能受损和死亡。
在随后的十多年里,各研究领域的科学家都在不断挖掘铁死亡与代谢健康、不同疾病的联系。尤其是肿瘤研究领域近些年提出了各种基于铁死亡机制诱导癌细胞死亡的新策略,比如美国西南医学中心团队曾发现一种小分子化合物N6F11可以选择诱导癌细胞的铁死亡抑制,延长胰腺癌小鼠生存期;另外,同济大学王平团队发表在《自然》的研究发现了一条依赖于7-脱氢胆固醇(7-DHC)水平的铁死亡途径,而靶向7-DHC就可以诱导和调控癌细胞的死亡。
图片来源:123RF
另一方面,代谢领域也认为铁死亡与脂肪代谢可能存在潜在的重要关系,因为铁死亡本身就依赖于脂质过氧化来发生。当铁死亡激活时,含有多不饱和脂肪酸的细胞膜脂会被氧化,清除氧化脂质的天然机制也会被抑制。而细胞内的脂质代谢和铁死亡之间有哪些调节机制呢?这一问题仍是一个谜团。
最近,浙江大学王福俤和闵军霞团队联合在《细胞-代谢》发表了重磅论文,研究发现无论是肥胖人类还是小鼠,脂肪组织中的铁死亡信号表达水平处于较低的水平。当研究者尝试激活小鼠体内的铁死亡信号后,它们脂肪组织中脂质累积出现减少,即使长期食用高脂饮食也可以获得这种好处。这一发现也为未来的肥胖干预策略提供了一种全新思路。

过去一些研究已经提示铁死亡与脂肪代谢的关系,比如补充铁可以激活脂肪酸氧化和提升线粒体功能。为此,研究者对公共的RNA测序数据库进行了重新整合分析,主要比对了肥胖与健康个体之间的腹部脂肪组织差异。结果他们发现了42个基因,可以被归类为与肥胖相关的铁死亡基因,这些基因在营养、饥饿、应激反应中显著富集。
此外,研究还找到了两个关键蛋白:ACSL4与Fth。前者是一种长链酰基辅酶A合酶,推动细胞内脂质过氧化的发生,是铁死亡的关键推动因素;后者则属于铁螯合系统,是潜在的铁死亡抑制分子。研究者发现肥胖个体的脂肪组织中,ACSL4表达往往更低,而Fth则会升高。这表明铁死亡信号的抑制与肥胖发生有着潜在联系。
研究者尝试在小鼠体内反其道行之,在脂肪组织中过表达了ACSL4或者抑制Fth蛋白,结果两种方式都能够阻止高脂饮食带来的脂肪增加、代谢障碍等问题。除此之外,研究者发现当小鼠食用高脂饮食8周后,在小鼠腹部皮肤白色脂肪上涂抹一种含有铁死亡激动剂RSL3的羊油霜,只需连续4周每天涂抹,就能显著帮助高脂饮食小鼠减轻体重。
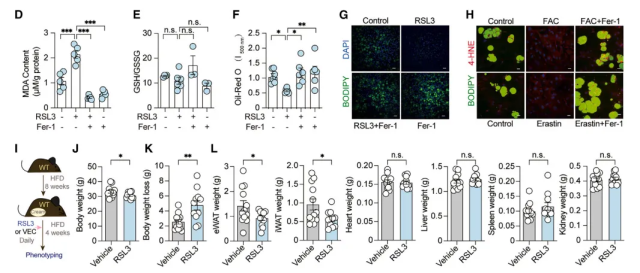
▲促进铁死亡信号可以帮助肥胖小鼠减少脂肪累积(图片来源:参考资料[1])
最后,新研究还发现脂肪组织中的铁死亡信号可以经由5,15-二羟基二十碳四烯酸(5,15-DiHETE)和低氧诱导因子-1α(HIF-1α)的信号轴来激活脂肪组织中的产热程序,这也是能加速脂肪代谢,预防肥胖发生的深层次原因。
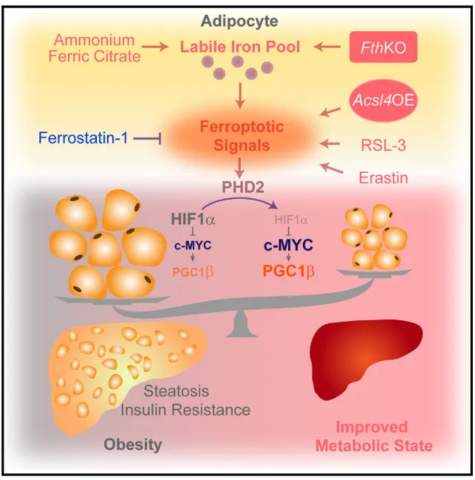
▲研究示意图(图片来源:参考资料[1])
这些发现不仅让我们重新认识了铁死亡信号在脂肪代谢与相关疾病中的关键作用,也为未来相关肥胖疗法的研发提供了全新思路。或许在不远的将来,也可能通过涂抹一种特制的药膏来抑制皮下脂肪累积,达到加速脂肪代谢和减肥的效果。
(来源:学术经纬)
参考文献:
[1] Wang X, Wu Q, Zhong M, Chen Y, Wang Y, Li X, Zhao W, Ge C, Wang X, Yu Y, Yang S, Wang T, Xie E, Shi W, Min J, Wang F. Adipocyte-derived ferroptotic signaling mitigates obesity. Cell Metab. 2024 Dec 21:S1550-4131(24)00456-X. doi: 10.1016/j.cmet.2024.11.010. Epub ahead of print. PMID: 39729998.
