公共卫生学术热点追踪
Cell重磅:揭开乙肝病毒感染人类的关键“开关”,为治愈乙肝带来新希望
据估计,全球范围内约有 3.25 亿人慢性感染了乙型肝炎病毒(HBV),尽管已有有效疫苗,HBV 仍导致了每年近 100 万人死亡。HBV 的慢性感染会对肝细胞造成长期损伤,使感染者面临进展性肝病风险,近一半的肝细胞癌是因为 HBV 慢性感染所致。
HBV 感染始于病毒通过钠离子-牛磺胆酸共转运多肽(NTCP)受体侵入肝细胞。随后,病毒衣壳被转运至核孔复合体,在核孔处解组装并释放 3.2 kb 的部分双链、松弛环形 DNA(rcDNA)基因组进入细胞核。rcDNA 经宿主滞后链合成机制修复为完全双链的共价闭合环形 DNA(cccDNA),人体细胞中的组蛋白迅速沉积于 cccDNA 形成微型染色体,作为 HBV 病毒转录的核心模板。
当前标准治疗方案(长期口服核苷类似物或短期注射干扰素-α)虽可抑制 HBV 病毒复制,但无法清除感染肝细胞内的 cccDNA。这种微型染色体的持续存在,成为慢性 HBV 感染难以根治的根本原因。
2025年2月20日,纪念斯隆·凯特琳癌症中心、威尔·康奈尔医学院及洛克菲勒大学的研究人员合作,在国际顶尖学术期刊 Cell 上发表了题为:A nucleosome switch primes hepatitis B virus infection 的研究论文。
该研究回答了一个困扰科学家几十年的难题——乙型肝炎病毒(HBV)究竟是如何感染肝细胞的,从而揭示了 HBV 的一个弱点,为开发乙肝新疗法打开了大门。
该研究通过创新性的体外 HBV 微型染色体模型,首次揭示了核小体作为“开关”调控 HBV X 基因的转录和表达,从而启动 HBV 的感染,这一发现填补了cccDNA 表观遗传调控的空白,阐明了 HBV 感染早期的染色质调控机制。该研究还提出了 CBL137 作为染色质破坏剂来清除 cccDNA,为乙肝的功能性治愈带来了新思路。

这项研究始于一次偶然的相遇和一个长期存在的悖论。
大约 6 年前,威尔·康奈尔医学院 的 Robert Schwartz 博士与纪念斯隆·凯特琳癌症中心的 Yael David 博士在一个学术会议上相遇。他们二人的研究方向看起来似乎没有什么重合,Robert Schwartz 致力于 HBV 研究,而 Yael David 专注于表观遗传对基因表达的调控。但 Yael David 发现,HBV 劫持了宿主细胞的表观遗传机制,甚至使用人类的组蛋白来调控它们的活性。不久之后,他们建立了合作。
引起他们研究兴趣的是一个关键的 HBV 病毒基因——X 基因,该基因编码一种名为 X 的蛋白质,X 蛋白是 HBV 在宿主细胞中建立高效感染及其病毒基因表达所必需的。
然而,X 蛋白是由 HBV 病毒自身基因编码的,这就带来了一个悖论——HBV 病毒感染宿主细胞依赖 X 蛋白,而 X 蛋白是 HBV 在宿主细胞中合成的,那么 HBV 是如何产生足够的 X 蛋白来驱动其基因表达并建立感染的呢?这个像“鸡生蛋还是蛋生鸡”的问题,困扰了科学家几十年之久。
此外,X 蛋白还会降解宿主细胞中参与 DNA 修复的蛋白,这不仅阻止了宿主细胞对 X 基因的沉默,还导致了宿主细胞中错误 DNA 因得不到有效修复而积累,从而增加癌症发生的风险。
当前,治疗乙肝的主要挑战之一是,现有的治疗方法可以阻止 HBV 的自我复制,但无法完全清除 HBV,导致其在肝脏内持续存在,并维持慢性感染。乙肝疫苗可以有效防治 HBV 感染,但这对于全世界数亿已感染人群来说没用。
研究团队首先将人类组蛋白与 cccDNA 复合重组,首次成功产生了 HBV 微型染色体,从而构建了一个乙型肝炎研究新平台,该平台不仅可以研究 HBV 的生物化学,还可以详细分析在感染的关键最初几个小时内发生了什么。
利用该平台,研究团队发现,HBV 感染后4-8小时,X 转录本占 HBV 病毒基因转录本的超 60%,这提示了 X 基因是最早表达的 HBV 基因,从而降解宿主沉默因子 Smc5/6 复合体。该研究还发现,为了制造 X 蛋白,HBV 的 DNA 需要被组织成 DNA-组蛋白复合物,也就是“核小体”。核小体就像一个串珠,HBV 的 DNA 是串,来自宿主细胞的组蛋白是珠子,核小体是染色质的组成部分,而染色质是组成染色体的物质。
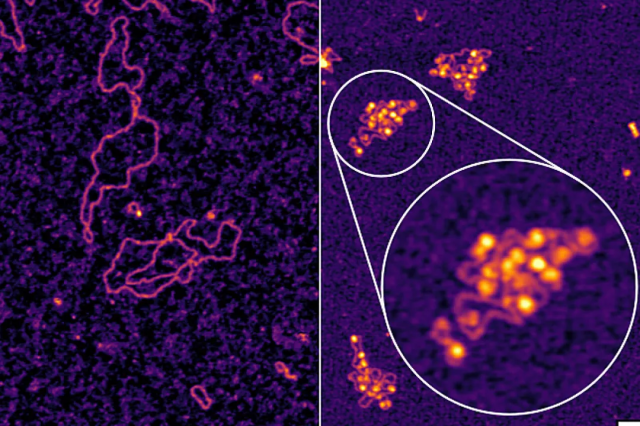
自然状态下的 HBV DNA 呈松弛的环形(左图),而在感染过程中它通过与人类组蛋白结合,从而染色质化,形成微型染色体(右图)。
传统观点认为,将 DNA 包装到核小体中,会阻碍或减缓细胞读取该基因以制造功能性蛋白质的能力。但在像人类这样的复杂生物体以及感染人类的病毒中,基因调控并不总是那么简单。核小体在 DNA 上的存在和定位对于指导细胞机制转录某些基因具有重要意义。
具体来说,该研究发现,cccDNA 上的核小体占据状态直接调控 X 基因转录活性,也就是说,cccDNA 上核小体的存在对于 X 基因转录并产生功能性的 X 蛋白是必需的。
这些发现为了解 X 基因如何被调控以及 HBV 如何建立感染打开了大门。更重要的是,该研究揭示来一个潜在的治疗机会:如果可以破坏这些染色质结构的形成,那么就可以破坏 HBV 启动感染以及维持感染的能力。
研究团队测试了 5 种已知能够损害染色质形成的小分子化合物,其中只有一种——CBL137,破坏了核小体的稳定性,从而抑制了 X 基因转录(将全长 X 基因转录水平降低了 78%),阻断了肝细胞中 X 蛋白的产生,将 HBV 对原代人类肝细胞的感染降低了 92%,且不影响细胞本身的活力。
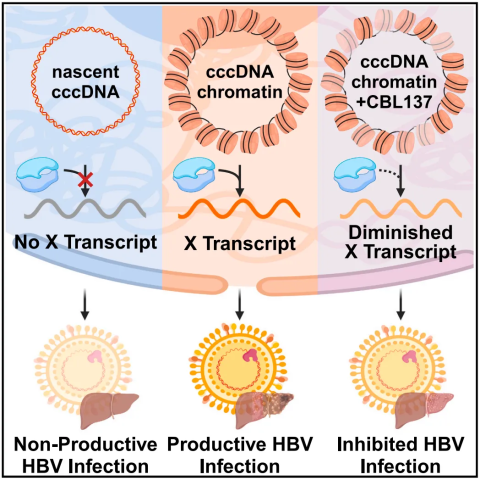
CBL137 是一种抗癌候选药物,相比其在癌症治疗临床试验中的剂量,它在非常低的浓度下就能阻断肝细胞中 X 蛋白的产生,这种低剂量只影响 HBV,没有对人类细胞产生影响。此外,CBL137 还可能对其他染色质 DNA 病毒(例如疱疹病毒、HPV)同样效果。
研究团队表示,接下来将在动物模型中验证 CBL137 的安全性和有效性,为进一步的临床治疗奠定基础。
总的来说,该研究通过创新性的体外 HBV 微型染色体模型,首次揭示了核小体作为“开关”调控 HBV 的 X 基因转录和表达,填补了cccDNA 表观遗传调控的空白,阐明了 HBV 感染早期的染色质调控机制。该研究还提出了 CBL137 作为染色质破坏剂来清除 cccDNA,为慢性乙肝的功能性治愈带来了新思路。
(来源:生物世界)
原文出处:Prescott NA, Biaco T, Mansisidor A, Bram Y, Rendleman J, Faulkner SC, Lemmon AA, Lim C, Tiersky R, Salataj E, Garcia-Martinez L, Borges RL, Morey L, Hamard PJ, Koche RP, Risca VI, Schwartz RE, David Y. A nucleosome switch primes hepatitis B virus infection. Cell. 2025 Feb 16:S0092-8674(25)00102-3. doi: 10.1016/j.cell.2025.01.033. Epub ahead of print. PMID: 39983728.
