公共卫生学术热点追踪
破解百年谜题!四川大学邓成团队最新Nature表明,组成型活性胰高血糖素受体驱动家禽高血糖!
作为身体能量的主要来源,血糖的维持对于整体健康和代谢稳态是不可或缺的。它主要由在脊椎动物中高度保守的胰高血糖素受体家族调节。与其他脊椎动物相比,禽类的血糖水平相对较高,但一个多世纪以来,其调节机制仍不清楚。
2025年3月3日,四川大学邓成团队在Nature在线发表题为“Constitutively active glucagon receptor drives high blood glucose in birds”的研究论文,该研究表明组成型活性胰高血糖素受体驱动家禽高血糖。

鸟类具有许多不同于其他脊椎动物的生理特征,其中最突出的是高血糖。其水平在代谢稳态过程中受到严格的调节,并且在脊椎动物中,通过接近每个物种的设定点特征的反馈机制来维持。然而,这种体内平衡在鸟类中被破坏了。自1879年首次报告鸟类葡萄糖体内平衡研究以来,鸟类表现出较高的血糖水平,几乎是哺乳动物的2倍,是两栖动物的7倍,两栖动物的血糖水平在所有脊椎动物中最低。尽管葡萄糖代谢在鸟类和哺乳动物之间高度保守,甚至在所有脊椎动物中,但鸟类维持如此高的血糖水平的机制仍不清楚。
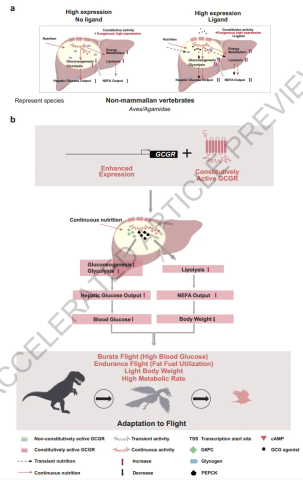
G蛋白偶联受体(GPCRs)在神经元活动、代谢和繁殖等生理过程中发挥重要作用。在所有脊椎动物中,葡萄糖稳态主要由B型GPCR胰高血糖素受体亚家族调节,包括胰高血糖素受体(GCGR)、胰高血糖素样肽1受体(GLP-1R)、胰高血糖素样肽2受体(GLP-2R)和胃抑制多肽受体(GIPR),在脊椎动物中具有高度序列相似性和功能保守性。GCGR家族的组织表达谱显示了哺乳动物和鸟类之间的差异。例如,在鸡中,GCGR在肝脏、脂肪组织和肌肉中的表达水平最高。在哺乳动物中,GCGR在肝脏中的表达最高,其次是肾脏。
调节组成活性GCGR血糖效应的机制(图源自Nature)
GCGR主要调节肝脏的葡萄糖代谢,包括糖原分解、糖异生和糖酵解。在脊椎动物中,糖异生和糖原分解是保守的,主要发生在肝脏中,产生大约85%的内源性葡萄糖。糖原磷酸化酶有两种不同的状态,糖原磷酸化酶a (GPa)和糖磷酸化酶b (GPb)。GCG诱导糖原磷酸化酶快速转化,磷酸化非活性状态GPb成为活性状态GPa,触发糖原分解。G蛋白Gs激活GCGR,导致环腺苷酸(cAMP)积累,上调磷酸烯醇式丙酮酸羧基激酶(Pepck,包括Pck1和Pck2)和葡萄糖-6-磷酸酶(G6pc,包括G6pc1和G6pc2)基因转录,促进糖异生。GCG-Gs轴也上调参与脂质代谢的下游基因,例如过氧化物酶体增殖物激活受体α(PPARα)。
该研究发现,鸟类胰高血糖素受体(GCGR)在肝脏的高表达与组成型激活的Gs信号传导依赖于不同结构域的相互作用。集中于调节肝细胞中组成型活性GCGR表达的体内实验通过下游信号通路激活。在鱼、爬行动物、鸟类和哺乳动物中导致相应的高血糖、快速肝脂质利用和高代谢率。此外,在鸡的近端基因区域发现了一个点突变,导致GCGR mRNA减少和体重增加。在小鼠中过度表达具有适度组成型活性的天然人类GCGR突变(hsGCGRH339R),证明这种变体的高水平表达增加了高血糖,同时减轻了体重。胰高血糖素受体的高表达和组成型活性的组合可能有助于鸟类祖先的飞行进化。
(来源:iNature)
原文出处:Zhang C, Xiang X, Liu J, Huang Y, Xue J, Sun Q, Leng S, Liu S, He X, Hu P, Zhan X, Qiu Q, Yang S, Brosius J, Deng C. Constitutively active glucagon receptor drives high blood glucose in birds. Nature. 2025 Mar 3. doi: 10.1038/s41586-025-08811-8. Epub ahead of print. PMID: 40031956.
