公共卫生学术热点追踪
Cell重磅:肠道菌群竟能通过产生的胆汁酸增强抗肿瘤免疫!一作已回国加入厦门大学
人体肠道中共生了数以万亿计的微生物,这些肠道微生物群产生的胆汁酸(bile acid,BA)与人体的生物学过程或疾病相关,但其因果效应在很大程度上仍不明确。
而最近,Cell 期刊发表的一项突破性研究显示,肠道微生物群代谢产生的一些特殊胆汁酸,竟能通过阻断雄激素受体(AR)信号,重塑免疫系统,显著抑制肿瘤生长并增强免疫治疗效果。这一发现为癌症治疗开辟了一条新的“肠道菌群-免疫”通路。
2025 年 4 月 15 日,康奈尔大学/威尔康奈尔医学郭春君团队(金文兵、肖乐怡为共同第一作者)在国际顶尖学术期刊 Cell 上发表了题为:Microbiota-derived bile acids antagonize the host androgen receptor and drive anti-tumor immunity 的研究论文。
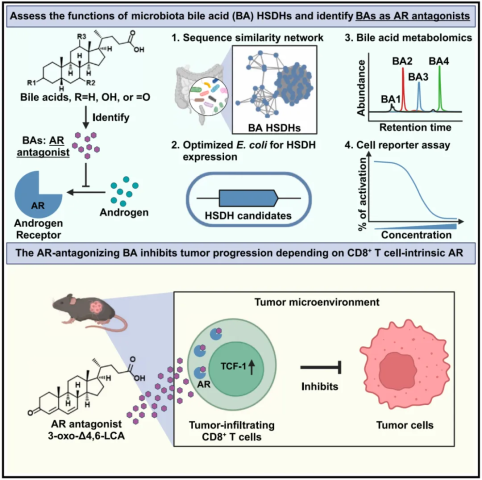
该研究结合生物信息学、胆汁酸代谢组学和微生物遗传学等方法,对 207 种潜在的微生物胆汁酸羟类固醇脱氢酶(HSDH)进行了功能分析,成功鉴定出 56 种新型胆汁酸,并发现其中一类胆汁酸是有效的雄激素受体(AR)拮抗剂,能够调控 AR 相关基因表达,且具有明确的人体相关性,并进一步展示了其中一种胆汁酸(3-oxo-△4,6-LCA)以依赖于 CD8+ T 细胞中 AR 信号通路的机制抑制肿瘤发生进展,同时增强免疫检查点抑制剂(anti-PD-1)的治疗效果。


金文兵博士
金文兵,2014 年于中山大学获得学士学位;2019 年于中国科学院上海有机化学研究所获得博士学位;2019-2024 年在康奈尔大学/威尔康奈尔医学院进行博士后研究,2024 年回国加厦门大学生命科学学院,任教授、博士生导师。
微生物“化学工厂”:胆汁酸的结构密码
胆汁酸不仅是消化脂肪的“帮手”,更是肠道菌群与人体对话的“分子信使”。传统认知中,胆汁酸通过与肝脏、肠道中的受体(例如 FXR、TGR5)相互作用调节代谢。但这项研究团队通过结合胆汁酸代谢组学与合成生物学,系统解析了肠道微生物群中 207 个潜在的羟类固醇脱氢酶(HSDH)的功能,首次绘制出微生物胆汁酸合成的“全景图谱”。
技术亮点:
1、基因功能“大筛查”:利用工程化大肠杆菌高效表达 207 种羟类固醇脱氢酶(HSDH),快速鉴定出了 74 种新型胆汁酸脱氢酶。
2、结构解析“放大镜”:结合核磁共振(NMR)和质谱技术,破解了 56 种新型胆汁酸的精确化学结构,其中多个分子在人类粪便中被检测到。
关键发现:肠道微生物可通过氧化、脱氢等反应,将常见胆汁酸“改装”成结构独特的异构体,例如将石胆酸(LCA)转化为 3-oxo-△4,6-LCA 等“变形体”。
意外发现:胆汁酸竟是雄激素受体的“分子开关”
当研究团队测试这些新型胆汁酸对激素受体的影响时,意外发现多个胆汁酸分子能强效抑制雄激素受体(AR)的活性。AR 是前列腺癌等激素依赖性癌症的关键驱动因子,而传统 AR 拮抗剂(例如恩杂鲁胺)常面临耐药性问题。
研究团队发现,在前列腺癌细胞中,这些胆汁酸显著下调 PSA、KLK2 等 AR 靶基因表达,抑制癌细胞增殖。具体来说,3-oxo-△4,6-LCA 等胆汁酸分子能像“假钥匙”一样占据雄激素受体(AR)的配体结合域,抑制 DHT 等雄激素激活受体,IC50 低至 99.7 nM(媲美现有药物)。
动物实验:重编程免疫系统,增强抗癌能力
研究团队在膀胱癌小鼠模型中进行了进一步验证,结果显示,口服 3-oxo-△4,6-LCA后,肿瘤体积缩小 60%,转移灶减少 75%,联合抗 PD-1 治疗时,疗效进一步提高,生存期显著延长。
研究团队进一步进行了单细胞测序分析,发现这类胆汁酸能够重编程肿瘤微环境中的CD8+ T 细胞,增强其干性,具有干细胞特征的 CD8+ T 细胞显著扩增:表达 TCF-1、CD62L 的“记忆干细胞”比例增加 3 倍,具备更强的持续抗肿瘤能力。
此外,这类胆汁酸的抗肿瘤效果在去势雄鼠中并不明显,敲除 T 细胞中的 AR 基因后,其抗癌效果完全消失,表明其抗肿瘤效果依赖于雄激素受体。
临床曙光:人类数据揭示转化潜力
研究团队进一步分析了人类临床样本,结果显示,前列腺癌患者血液中 AR 拮抗型胆汁酸水平与 PSA(前列腺癌的肿瘤标志物)呈显著负相关。而在健康人群的肠道微生物群中,相关代谢酶基因丰度越高,血清胆汁酸抗癌活性越强。
这些结果提示我们,将来或可通过益生菌或基因工程菌定向产生活性胆汁酸,与免疫检查点抑制剂连用,破解耐药难题,提高癌症治疗效果。此外,男性癌症患者可能从肠道微生物群-胆汁酸-雄激素受体调控中获益更多。
这项研究颠覆了我们对胆汁酸的传统认知,揭示了肠道微生物代谢物调控宿主免疫系统的精妙机制。这项研究也表明,将生物信息学、胆汁酸代谢组学和微生物遗传学相结合的方法,可以扩展我们对微生物群代谢潜力的认识,并揭示了微生物群胆汁酸与雄激素受体之间意外的相互作用及其在调节宿主生物学中的作用。
(来源:生物世界)
原文出处:Jin WB, Xiao L, Jeong M, Han SJ, Zhang W, Yano H, Shi H, Arifuzzaman M, Lyu M, Wang D, Tang YA, Qiao S; JRI IBD Live Cell Bank Consortium; Yang X, Yang HS, Fu J, Sonnenberg GF, Collins N, Artis D, Guo CJ. Microbiota-derived bile acids antagonize the host androgen receptor and drive anti-tumor immunity. Cell. 2025 Apr 14:S0092-8674(25)00256-9. doi: 10.1016/j.cell.2025.02.029. Epub ahead of print. PMID: 40239649.
