公共卫生学术热点追踪
Science:华人学者揭开男性“中年发福”背后的秘密
在中年及以后,想保持身材苗条可能颇具挑战,尤其是男性,中年时期(大约40-65岁)体内脂肪往往会增加,尤其是腹部内脏器官周围的内脏脂肪组织(VAT)扩张明显,而不是储存在皮肤下的皮下脂肪组织(SAT),导致肚子明显,腰围增粗,也就是所谓的“中年发福”。而内脏脂肪组织的增加与胰岛素敏感性下降以及代谢疾病风险升高有关。
实际上,人体在 20-60 岁期间的总能量消耗相对保持稳定。即然能量消耗大致保持不变,那么,随着年龄增加,内脏脂肪组织为何会持续增加?这个问题的答案,目前仍不清楚。
2025 年 4 月 25 日,希望之城医学中心(City of Hope)王琼团队联合加州大学洛杉矶分校(UCLA)杨霞团队(王冠、李高岩为论文共同第一作者)在国际顶尖学术期刊 Science 上发表了题为:Distinct adipose progenitor cells emerging with age drive active adipogenesis 的研究论文。
该研究发现,中年时期内脏脂肪中的脂肪前体细胞(APC)的脂肪生成能力会显著提高,并通过单细胞 RNA 测序发现了该年龄阶段会出现一种特殊的、中年特异性脂肪前提细胞——CP-A,其展现出增强的增殖活性和脂肪生成能力。该研究进一步发现,LIFR 信号通路对 CP-A 细胞的脂肪生成及内脏脂肪扩张具有不可或缺的调控作用,移植 LIFR 能够预防中年时期的内脏脂肪不良扩张,而不影响年轻时期。
这些发现揭示了年龄相关的脂肪重构的核心机制,首次从细胞层面揭示了“中年发福”这一现象的生物学机制,为理解年龄相关代谢性疾病提供了重要理论依据。

脂肪组织在调控多种激素和代谢过程中发挥着关键作用,并表现出显著的成分和表型可塑性。从中年到早期衰老阶段,成年人的内脏脂肪组织(VAT)通常会出现显著增加。内脏脂肪的堆积被认为是多种代谢紊乱的重要风险因素。脂肪组织通过两种主要机制积累:脂肪细胞肥大(脂肪细胞的体积增大)和脂肪生成(新生脂肪细胞)。然而,从中年到早期衰老阶段促进脂肪组织积累的具体机制,目前仍不清楚。
脂肪生成指通过脂肪前体细胞(APC)的增殖和分化产生新脂肪细胞的过程。之前的研究表明,在体外二维(2D)培养环境中,老年的人类或啮齿动物的脂肪前体细胞的脂肪生成能力减弱。
在这项最新研究中,研究团队通过体内谱系追踪小鼠模型、脂肪祖细胞移植的三维(3D)动态追踪(持续监测至中年期),以及单细胞 RNA 测序技术,首次识别出中年阶段产生的特殊脂肪前体细胞亚群——CP-A。研究团队对这些年龄特异性脂肪前体细胞的功能评估,揭示了脂肪生成在中年至早期衰老阶段驱动内脏脂肪组织(VAT)堆积的具体机制。
该研究发现,12 个月大的中年雄性小鼠因脂肪组织质量增加而体重上升,尤其是内脏部位。相比之下,雌性小鼠体重仅略有增加。在谱系追踪小鼠模型中追踪脂肪生成情况后发现,与年轻成年小鼠脂肪细胞的低更新率不同,12 个月大的雄性小鼠在喂食标准饲料的情况下,其内脏脂肪组织中超过 80% 的脂肪细胞是新生成的。伴随着这种大规模的脂肪生成,中年小鼠出现了脂肪细胞萎缩、内脏脂肪堆积、能量消耗减少以及胰岛素抵抗。
对移植的脂肪前体细胞(APC)进行的三维分析定量显示,中年小鼠的脂肪前体细胞的脂肪生成率远高于年轻小鼠,这表明这些脂肪前体细胞自身获得了更高的脂肪生成潜能。
研究团队对这些脂肪前体细胞进行单细胞 RNA 测序后发现,在小鼠和人类中均存在一种新的中年特异性脂肪前体细胞,简称 CP-A。CP-A 在体外和体内均表现出高增殖和分化能力。研究团队发现,小鼠 9 个月大时,内脏脂肪组织中的 CP-A 数量增加,在 12 个月大时达到峰值,到 18 个月大时则急剧下降。
该研究还发现,白血病抑制因子受体(LIFR)在 CP-A 中高表达,并将其确定为 CP-A 的功能性标志物。药理学抑制和基因干扰实验表明,LIFR 对 CP-A 的脂肪生成能力不可或缺。而抑制 LIFR 并不影响年轻的脂肪前体细胞的脂肪生成能力,这表明 LIFR 信号传导对于 CP-A 是特异性必需的。在小鼠早期衰老期间长期使用抑制剂来抑制 LIFR,可防止内脏脂肪的增加。因此,靶向抑制 LIFR 可选择性地阻断中年阶段内脏脂肪的不良扩张。
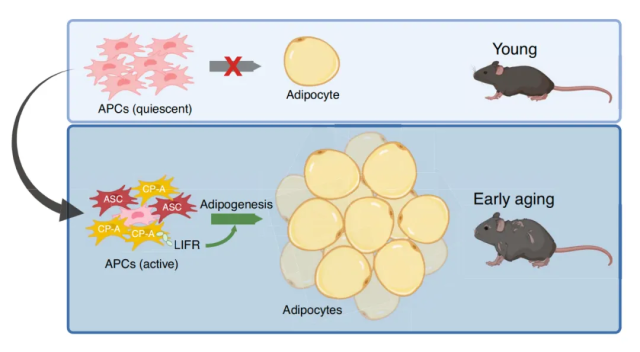
脂肪生成导致年龄相关的内脏脂肪组织堆积
总的来说,该研究揭示了在中年时期,脂肪前体细胞(APC)的脂肪生成对内脏脂肪组织(VAT)的扩张有重大贡献。该研究发现了一种新的中年特异性脂肪前体细胞——CP-A,其在体外和体内均具有高脂肪生成能力,并确定了 LIFR 信号传导是 CP-A 特异性的脂肪生成机制,这些发现加深了我们对脂肪组织的早期衰老过程的理解,首次从细胞层面揭示了“中年发福”这一现象的生物学机制,并提供了干预时机和干预靶点。
该研究的一个关键发现是,年轻成年个体的脂肪细胞更新率很低,但在中年时期脂肪生成过程会被激活。脂肪生成能力的增强使脂肪前体细胞有别于大多数其他成体干细胞,后者通常随着年龄的增长增殖和分化能力会下降。此外,由于脂肪生成的增强以及 CP-A 细胞亚群的出现主要发生在雄性内脏脂肪组织中,且仅在中年和早期衰老阶段发生,因此这些事件具有位置、阶段和性别的特异性。
这些研究结果为年龄相关代谢紊乱的病理生理学提供了基本理解,这可能对预防和治疗年龄相关疾病具有关键意义,从而促进健康老龄化。
(来源:生物世界)
原文出处:Wang G, Li G, Song A, Zhao Y, Yu J, Wang Y, Dai W, Salas M, Qin H, Medrano L, Dow J, Li A, Armstrong B, Fueger PT, Yu H, Zhu Y, Shao M, Wu X, Jiang L, Campisi J, Yang X, Wang QA. Distinct adipose progenitor cells emerging with age drive active adipogenesis. Science. 2025 Apr 25;388(6745):eadj0430. doi: 10.1126/science.adj0430. Epub 2025 Apr 25. PMID: 40273250.
