公共卫生学术热点追踪
武汉病毒所合作首次阐明猴痘病毒核心蛋白酶底物识别机制并开展高效抗猴痘病毒化合物的发现研究
2025年4月22日,国际顶级学术期刊Nature以“加速预览(Accelerated Article Preview)”的形式在线发表了中国科学院武汉病毒研究所张磊砢研究员与上海科技大学、中国科学院上海药物研究所、清华大学和重庆医科大学等多家单位合作的题为“Substrate recognition and cleavage mechanism of the monkeypox protease ,Core protease”的最新研究成果。该工作在国际上首次阐明了猴痘病毒核心蛋白酶(Core protease ,CorePro)三维结构,揭示了核心蛋白酶底物识别与催化的分子机制,通过基于结构的药物设计策略发现了具有高效酶抑制活性和广谱抗正痘病毒活性(猴痘病毒、痘苗病毒)的先导化合物,并阐明其微观作用机制。该系统性工作证实了正痘病毒的核心蛋白酶是一个全新的广谱抗病毒药物靶标,为靶向核心蛋白酶开发广谱高效抗正痘病毒药物提供了坚实的结构基础和良好的先导化合物。
猴痘病毒属于正痘病毒属(orthopoxvirus genus),该属还包含3种已知的人畜共患病毒,分别是天花病毒(VARV)、痘苗病毒(VACV)和牛痘病毒(CPXV)。历史上,人类与天花病毒斗争了近千年,曾有数亿人因天花病毒感染死亡。自1970年刚果民主共和国报道首例猴痘病例以来,猴痘病毒主要流行于非洲中部和西部,在非洲以外地区很少发现。2022年5月,猴痘病毒扩散传播至英国,并迅速席卷全球,截至2025年2月28日,全球131个国家和地区共报道了13.4万例猴痘病例,死亡291例。猴痘疫情分别于2022年7月23日和2024年8月15日两次被WHO宣布为国际关注的突发公共卫生事件(PHEIC)。目前尚无具有明确疗效的抗猴痘病毒药物,因此发现和确证抗猴痘病毒新靶标,开发结构新颖、低毒高效且具有自主知识产权的抗猴痘病毒药物具有重大意义,既可用于应对当前猴痘疫情,又可作为国家储备药以应对未来正痘病毒暴发危机。
正痘病毒是一类包膜的双链DNA病毒,复制过程中会编码一种高度保守的核心蛋白酶(在痘苗病毒和猴痘病毒中称为I7L,在天花病毒中称为K7L),核心蛋白酶通过水解核心蛋白前体驱动感染性成熟颗粒(IMV)的形成,在正痘病毒生命周期中发挥了重要作用,因此阐明其三维结构和底物识别机制,并基于此开展先导化合物的发现研究具有重要意义。
研究团队成功解析了猴痘病毒核心蛋白酶的高分辨率三维结构(图1)。核心蛋白酶为二聚体,每个单体可分为N端结构域NTD、催化结构域CD和C端结构域CTD。活性中心位于催化结构域,包含一个特征的催化三联体Cys328-His241-Asp258。研究团队通过高通量筛选策略发现泛半胱氨酸蛋白酶抑制剂E64d具有潜在的核心蛋白酶抑制效果和抗猴痘病毒活性,但活性较弱。猴痘病毒核心蛋白酶与E64d的复合物结构解析发现其与活性中心附近一个非催化Cys237残基发生共价结合,未能完全占据底物结合口袋。
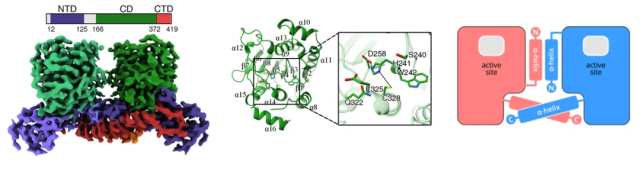
图1 猴痘病毒核心蛋白酶的整体结构、催化结构域特征及二聚化模式
为了开发更强效的猴痘病毒核心蛋白酶抑制剂,研究团队开展了猴痘病毒核心蛋白酶底物识别和催化机制的研究。基于核心蛋白酶天然底物P25K序列,利用醛基替换切割断裂的酰胺键设计了底物类似物I-G18,期望能够与催化中心Cys328共价结合,模拟催化中间体的结构特征。研究团队通过冷冻电镜技术,成功解析了CorePro-I-G18复合物结构(图2)。与apo结构相比,在底物的诱导下,核心蛋白酶活性中心会发生一系列构象变化,暴露出催化活性中心,完成底物的水解。S1和S2口袋形成了特征性的狭长空腔,仅可容纳Gly(P1位)和Ala(P2位)等侧链尺寸较小的氨基酸残基,合理解释了正痘病毒核心蛋白酶Ala-Gly序列识别专一性。
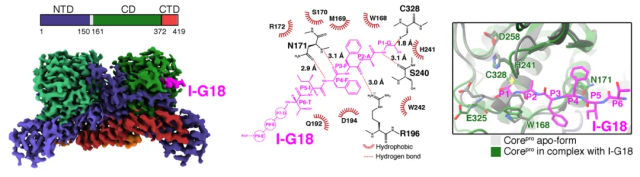
图2 猴痘病毒核心蛋白酶的底物识别机制
以核心蛋白酶的底物识别机制为基础,研究团队利用基于结构的药物设计策略设计合成了拟肽类抑制剂A1~A6,引入P1~P5片段分别占据核心蛋白酶S1~S5底物结合口袋,同时在P1位置连接亲电弹头warhead与催化中心Cys328残基共价结合(图3)。活性测试发现A2~A6具有高效的猴痘病毒核心蛋白酶抑制活性(IC50为44.9~100.3 nM),其中化合物A3活性最优,IC50达到44.9 nM,较底物衍生的九肽醛I-G18提高7倍(I-G18的IC50为314 nM)。
为了阐明酶抑制活性的差异,研究团队解析了A1、A3和A4与核心蛋白酶的复合物结构,结果显示三个化合物均可与催化中心的Cys328残基共价结合,同时能够较好地占据底物结合口袋,其中A3的P4片段F原子能够与Asp194残基形成额外氢键相互作用,合理揭示了A3酶抑制活性更优的原因。抗病毒活性测试发现,化合物A3~A6具有较强的抗猴痘病毒活性(EC50为1.98~7.31 μM)和抗痘苗病毒活性(EC50为1.39~3.66 μM),具有广谱性;同时表现出良好的安全性,CC50均大于200 μM。相较于九肽醛I-G18,拟肽类化合物的抗病毒活性显著提高(I-G18在50 μM浓度下未显示出抗病毒活性)。研究结果表明,A3~A6是良好的先导化合物,有望通过进一步成药性结构优化开发出广谱抗正痘病毒药物。
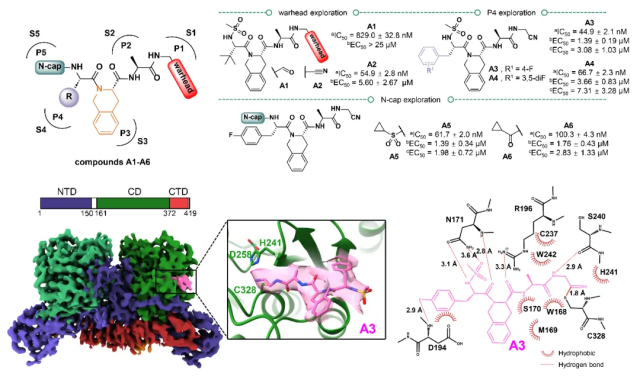
图3 核心蛋白酶抑制剂的设计发现与作用模式研究
(a猴痘病毒核心蛋白酶抑制活性;b抗痘苗病毒活性;c抗猴痘病毒活性)
武汉病毒所肖庚富学科组博士后曹浚垣为共同第一作者之一,实验师尚卫娟、助理研究员张宇旻参与研究工作。该研究工作获得了教育部学科突破先导项目、国家自然科学基金、中国科学院战略性先导科技专项、上海市重大传染病和生物安全研究院、上海尚思自然科学研究院等项目的资助。上海科技大学生物电镜平台、上海同步辐射光源、国家蛋白质科学研究(上海)设施等平台为本工作提供了技术支持。
(来源:生物谷)
原文出处:Gao Y, Xie X, Zhang X, Cao J, Lan W, You T, Li D, Dong X, Dai W, Xiang Y, Hu S, Shang W, Wu B, Zhang Y, Xu J, Liu X, Wang H, Hu W, Zhang M, Duan Y, Cui W, Zhou H, Mao S, Jia H, Sun Z, Jia M, Yin Y, Nguyen HC, Yang K, Yang B, Yang X, Ji X, Xiao G, Wang W, Zhang L, Rao Z, Liu H, Yang H. Substrate recognition and cleavage mechanism of the monkeypox protease, Core protease. Nature. 2025 Apr 22. doi: 10.1038/s41586-025-09014-x. Epub ahead of print. PMID: 40262633.
