公共卫生学术热点追踪
诺奖得主封面研究!mRNA疫苗中加入IL12,极大增强肿瘤或传染病疫苗的细胞免疫应答!
脂质纳米颗粒(LNP)封装的mRNA疫苗通过有效生成CD8 T细胞记忆,为针对胞内病原体和癌症的长期免疫提供了新策略。然而,如何优化此类疫苗以诱导强效且持久的CD8 T细胞应答仍是挑战。
IL-12是由 IL-12p40 和 IL-12p35 亚基组成的异二聚体细胞因子,通过其受体发出信号,该受体在自然杀伤(NK)细胞和T细胞上表达,促进这些细胞增殖和产生干扰素-γ(IFN-γ)。因此,IL-12已被用作疫苗佐剂,以促进针对各种寄生虫、细菌和病毒感染以及癌症的细胞免疫。
6月6日,宾夕法尼亚大学Christopher A. Hunter、Drew Weissman通讯在《Science immunology》发表论文“An Il12 mRNA-LNP adjuvant enhances mRNA vaccine–induced CD8 T cell responses”,发现虽然内源性IL-12对mRNA-LNP疫苗的CD8 T细胞启动非必需,但共递送编码IL-12的mRNA-LNP(LNP–IL-12)可显著增强疫苗诱导的CD8 T细胞数量、功能及保护效力。并且该研究登上了本期Science immunology杂志封面。

IL-12 mRNA增强CD8+T细胞的反应
首先,他们合成了编码IL-12两个亚基p40和p35密码子优化的Ψ-mRNA,并封装在LNP中(图1A)。这些编码序列通过灵活的GS接头连接,使两个亚基可以共同翻译并有效地异二聚化成功能性IL-12。
随后发现,使用LNP-IL12孵育WT和IL12p40缺失的 BMDM细胞时,能诱导IL-12的产生并且IL12p40的分泌呈剂量依赖性。
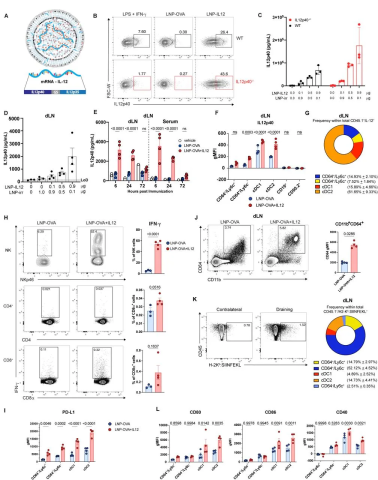
图1 IL-12 mRNA-LNPs 诱导 IL-12p40 蛋白质的产生
肌肉注射LNP-IL12到WT小鼠,发现其剂量依赖性地翻译为引流淋巴结(dLN)中的IL-12,且在治疗后6小时达到峰值约3.5-4 ng/mL,并在72小时后恢复到基础水平(图1B-E)。
为了确定产生IL-12的细胞类型,使用5μg LNP-OVA+IL12或LNP-OVA免疫IL12p40缺陷小鼠,经过16小时后,将来自dLN的细胞与蛋白质转运抑制剂孵育4小时,然后对表面标志物和细胞内细胞因子进行染色。结果表明,在LNP-OVA+IL12免疫下,B细胞和淋巴细胞没有表达IL-12,但在CD64+单核细胞 (Ly6c + ) 、巨噬细胞 (Ly6c - ) 和cDC中很容易检测到IL-12的表达(图1G)。
由于接种mRNA-LNP会激活和招募免疫细胞至dLN。因此他们研究了 IL-12 mRNA 对这些细胞群的影响。在仅使用LNP-OVA免疫的小鼠中无法显著产生IFN-γ,而当将这些颗粒与LNP-IL12结合使用时,约有50%的NK细胞、0.4%的CD8+和0.04%的CD4+T细胞分泌IFN-γ(图1H)。
接种疫苗后72小时,呈递表位SIINFEKL的细胞中最常见的是CD64+巨噬细胞和CD11c+树突状细胞。LNP-IL 12的加入不会影响呈递抗原的细胞的数量或组成,但与这些APC群体(特别是cDC2)中CD80、CD86和CD40的表达增加有关(图1L)。
因此,LNP-IL12的递送会导致dLN中IL-12的暂时产生,并伴随免疫细胞浸润的改变、增加IFN-γ的产生和局部抗原呈递细胞的激活
IL-12 mRNA增强效应CD8+T细胞扩增
为了研究将 LNP-IL12 掺入 mRNA 疫苗接种对 CD8 + T 细胞反应的影响,随后他们将 WT OT-I T 细胞转移到 C57BL/6 小鼠中,并在接种 LNP-OVA 或 LNP-OVA+IL12 后追踪 CD8 + T 细胞的反应。
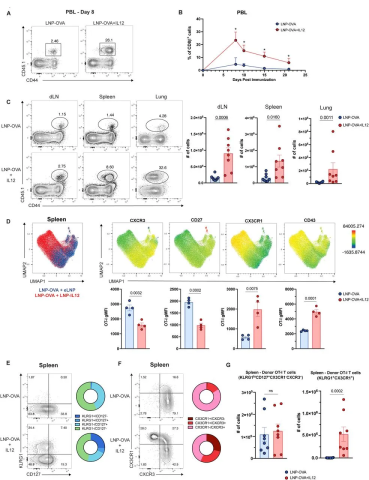
图2 LNP-IL12 的加入可增强疫苗特异性 CD8+ T 细胞扩增并改变表型
结果显示,接受 LNP-OVA+IL12 的小鼠中 CD8 + T 细胞的反应频率增加了4倍以上(图2A,B)。LNP-IL12 也导致肺、淋巴结和脾脏中 CD8 + T 细胞的数量增加(图2C)。通过细胞表面标志物的分析,发现与接受 LNP-OVA 的小鼠相比,在接受 LNP-OVA+IL12 的小鼠中,CXCR3、CX3CR1、KLRG1、CD43 和 CD27 的异质性表达更多(图 2D-F)。
这些结果表明,IL-12 的加入不会显著改变具有记忆潜力的 OT-I T 细胞 (KLRG1 - CX3CR1 - CD127 + CXCR3 + ) 的数量,但会导致更多终末分化的效应 OT-I T 细胞 (CX3CR1 + KLRG1 + )的数量增加(图 2G )。
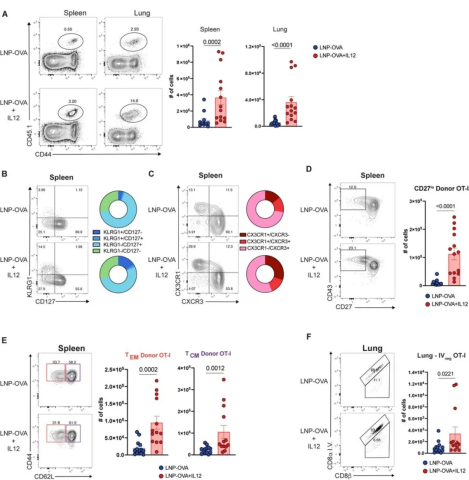
图3 将 LNP-IL12 纳入疫苗接种会导致特异性性 OT-I T 细胞的效应细胞和记忆细胞分化发生持续改变
接受LNP-OVA+IL12的小鼠中,CD27低表达细胞群扩大(图3D),这与二次攻击后的杀伤能力增加有关,并且中枢记忆(CD127 + CD11a + CD44 high CD62L +)和效应记忆(CD127 + CD11a + CD44 high CD62L -)OT-I CD8 + T细胞群有所增加(图3E)。
此外,当给接种疫苗的小鼠静脉注射抗CD8α荧光抗体,用来区分血管和实质CD8 + T细胞群时,发现LNP-IL-12 与更多的实质CD8 + T细胞相关(图4F )。因此,将LNP-IL12加入mRNA-LNP疫苗接种中可增加组织中的记忆CD8+T细胞群。
IL-12 mRNA-LNPs 增强 OT-I 功能
为了研究 mRNA疫苗接种中LNP-IL12对CD8+T细胞功能的影响,他们将OT-I CD8+T细胞移植到小鼠体内。在接种后的第8天和第29天,用表位 SIINFEKL 肽重新刺激每组脾细胞,并检测IFN-γ分泌和CD107a脱颗粒酶表达。
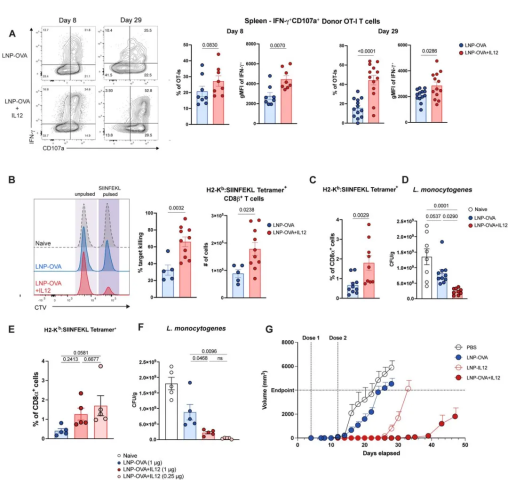
图4 IL-12 增强效应功能并增强治疗和预防性疫苗的保护作用
结果显示,接种后第8天和第29天,LNP-IL12均导致OT-I CD8+T细胞分泌的IFN-γ水平增加,并增加了脱颗粒表达(图4A)。在体内细胞毒性T淋巴细胞实验中,接种LNP-OVA的小鼠杀死了约30%的靶细胞,而加入IL12 mRNA后,杀伤水平翻了一倍(图4B)。
此外,在接种疫苗后4周,接受表达OVA 的单核细胞增生李斯特菌菌株(Lm-OVA)的攻击时,接受LNP-OVA+IL12免疫的小鼠中,循环OVA特异性CD8+T细胞的频率更高(图4C),并且观察到最高水平的保护。此外,降低LNP-OVA+IL12剂量仍能增强对单核细胞增生李斯特菌的保护作用(图4E)。
LNP-IL12增强疫苗抗肿瘤效果
随后,他们在构建了表达OVA的B16F0黑色素瘤小鼠模型,并给小鼠注射了对照组、LNP-OVA、LNP-OVA+IL12或仅LNP-IL12。结果显示,仅接受dPBS的小鼠在植入后的第8天就出现可触及的肿瘤大小,并在第15天达到人道终点肿瘤体积。
接受LNP-OVA的小鼠的肿瘤终点时间延迟到了第11天,但大多数小鼠在植入后的第20天达到人道终点肿瘤体积。与此相反,仅接受LNP-IL12的小鼠的肿瘤生长明显延迟,而只有接受LNP-OVA+IL12的组合治疗的小鼠在第30天继续抑制了肿瘤的生长(图4G)。
总结
综上所述,这项研究表明,使用 IL-12 mRNA-LNP 可以增强疫苗接种的免疫反应。IL-12 mRNA-LNP 能够促进 CD8+T 细胞的生长和活化,从而增强免疫应答。与仅使用 mRNA-LNP 疫苗相比,IL-12 mRNA-LNP 疫苗能够延迟肿瘤的生长,并在体内继续抑制肿瘤的发展。
此外, IL-12 mRNA-LNP 的使用还可以减少每剂疫苗所需的 mRNA-LNP 量,从而降低了潜在的副作用。这些发现表明 IL-12 mRNA-LNP 作为疫苗佐剂的潜力,未来可能为癌症治疗和预防性疫苗接种提供新的策略。

(来源:生命科学前沿)
原文出处:Aunins EA, Phan AT, Alameh MG, Dwivedi G, Cruz-Morales E, Christian DA, Tam Y, Bunkofske ME, Peñafiel AZ, O'Dea KM, Merolle M, Furey C, Scott P, Vonderheide RH, Hensley SE, Kedl RM, Weissman D, Hunter CA. An Il12 mRNA-LNP adjuvant enhances mRNA vaccine-induced CD8 T cell responses. Sci Immunol. 2025 Jun 6;10(108):eads1328. doi: 10.1126/sciimmunol.ads1328. Epub 2025 Jun 6. PMID: 40478935.
