公共卫生学术热点追踪
Cell:刘光慧团队等发现50岁是人类衰老转折点,血管系统首当其冲
蛋白质是生命的基石。然而,人体各组织衰老的蛋白质组蓝图仍是一片未知领域。
2025 年 7 月 25 日,中国科学院动物研究所刘光慧研究员、国家生物信息中心张维绮研究员、中国科学院动物研究所曲静研究员与四川大学华西医院杨家印教授合作团队在 Cell 期刊发表题为:Comprehensive Human Proteome Profiles Across a 50-Year Lifespan Reveal Aging Trajectories and Signatures 的研究论文。
该研究首次融合超高灵敏度质谱技术与机器学习算法,系统构建了横跨人类 50 年生命周期的蛋白质组衰老图谱,涵盖七大生理系统、13 种关键组织,从蛋白视角呈现了机体增龄性演变的全景式动态景观。
该研究显示,人类在 50 岁左右出现衰老转折点,血管是较早衰老且明显易受衰老影响的组织,并确定了包括 GAS6 在内的驱动血管和全身衰老的候选衰老蛋白。

破译衰老密码:首个多器官蛋白质组衰老图谱
研究团队收集了 76 名 14-68 岁人群的 516 份样本(涵盖心脏、主动脉、肺、肌肉等13种器官),运用高精度质谱技术绘制了全球首个跨越半世纪的人类多组织蛋白质组图谱。
该研究鉴定出了 12771 种蛋白质,进而建立了器官特异性蛋白表达特征。研究团队发现,mRNA 与其翻译的蛋白质之间的相关性随年龄增长而显著下降,尤其是在脾脏、肌肉和淋巴结中,衰老导致转录组与蛋白质生产之间出现“脱钩”现象。
衰老的核心机制:蛋白质稳态崩溃
该研究发现,随着年龄增长,维持蛋白质质量的“工厂”全线衰退:
1、合成能力下降:核糖体蛋白、氨基酸合成酶减少;
2、折叠运输失灵:分子伴侣蛋白显著降低;
3、垃圾堆积成灾:淀粉样蛋白、免疫球蛋白在多个器官异常累积,形成“淀粉样蛋白-免疫球蛋白-补体”炎症信号轴。
这些发现解释了为何老年人易发慢性炎症疾病,也为阿尔茨海默病等淀粉样病变提供新线索。
器官衰老时钟:血管是“衰老起搏器”
研究团队使用机器学习算法构建了 13 种器官的蛋白质生物学年龄时钟(预测精度达0.74-0.95),结果显示:
1、50 岁是衰老转折点:45-55 岁期间蛋白质组剧烈波动;
2、血管最早衰老:主动脉在 30 岁已出现显著变化,远早于其他器官。
衰老的帮凶:血液中的促衰因子
血管不仅是衰老受害者,更是全身衰老的驱动者,发挥着“衰老枢纽”(senohub)的核心调控功能,驱动并放大全身多器官的系统性衰老进程。
该研究发现,衰老血管高表达 GAS6 等促衰蛋白,注射 GAS6 的中年小鼠出现肌肉无力、血管硬化、多器官炎症等衰老症状。此外,该研究还发现,GPNMB、COMP 等 7 种蛋白在血液和器官中同步升高,可作为衰老标志物,用于非侵入性评估器官衰老。
论文通讯作者刘光慧研究员表示,血管可能就像就像一个管道,将促衰老分子输送到全身各个角落。
抗衰老新策略:靶向“促衰蛋白”
这项研究首次从蛋白质组维度揭示了器官衰老的时空规律,提供了未来清晰的抗衰老干预路径:
- 清除衰老细胞:针对 GPNMB 等膜蛋白开发 CAR-T 细胞疗法;
- 阻断促衰因子:使用抗体中和 GAS6、SAP 等循环蛋白;
- 早期干预窗口:50 岁前针对血管保护可能延缓全身衰老。
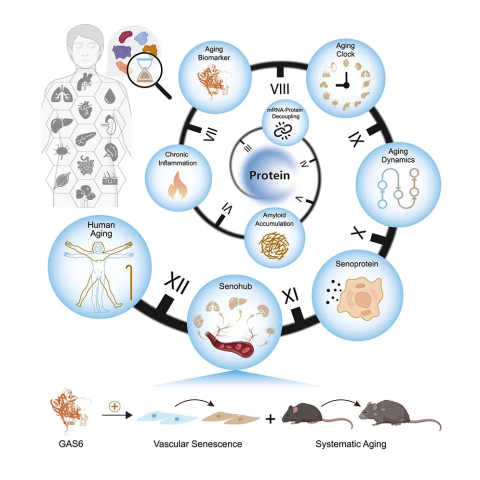
该研究的亮点:
- 绘制了跨越 50 年的人体器官蛋白质组蓝图;
- 转录组-蛋白组脱钩和蛋白质稳态失衡是衰老组织的标志;
- 人体器官蛋白质组时钟揭示衰老转折点与不同步性;
- 循环中的衰老蛋白促进血管和全身衰老。
总的来说,研究团队对来自 13 种人体组织(心脏、主动脉、肺、肌肉等)的 516 个样本进行了全面的蛋白质组学和组织学分析,这些样本跨越了五十年的时间。这一动态图谱揭示了广泛的转录组-蛋白质组脱钩以及蛋白质稳态下降,其特征为淀粉样蛋白的积聚。基于与衰老相关的蛋白质变化,研究团队开发了组织特异性蛋白质组学衰老时钟,并描绘了器官层面的衰老轨迹。时间分析显示,人类在 50 岁左右出现衰老转折点,血管是较早衰老且明显易受衰老影响的组织。研究团队进一步定义了一种与组织起源相匹配的衰老血浆蛋白质组特征,并确定了包括 GAS6 在内的驱动血管和全身衰老的候选衰老蛋白。
该研究通过整合蛋白质组大数据、人工智能建模与多维度功能验证,首次提出了“蛋白质稳态失衡-血管衰老枢纽”模型,为从蛋白质的角度全面理解人类衰老奠定了基础,也为系统性衰老机制提供了新范式。
(来源:生物世界)
原文出处:Ding Y, Zuo Y, Zhang B, Fan Y, Xu G, Cheng Z, Ma S, Fang S, Tian A, Gao D, Xu X, Wang Q, Jing Y, Jiang M, Xiong M, Li J, Han Z, Sun S, Wang S, He F, Yang J, Qu J, Zhang W, Liu GH. Comprehensive human proteome profiles across a 50-year lifespan reveal aging trajectories and signatures. Cell. 2025 Jul 22:S0092-8674(25)00749-4. doi: 10.1016/j.cell.2025.06.047. Epub ahead of print. PMID: 40713952.
