公共卫生学术热点追踪
Adv Sci丨中山大学夏建川等人研究揭示了EBV相关上皮癌中肿瘤相关中性粒细胞免疫抑制的新机制
尽管EBV相关上皮癌在免疫学上被归类为“热”肿瘤,但其对免疫疗法的应答并不理想。越来越多的证据表明,治疗失败是由于EBV建立的免疫抑制性肿瘤微环境所致。
2025年7月21日,中山大学夏建川、Yang Qi、Pan Qiuzhong共同通讯在Advanced Science在线发表题为“The CXCL10-CXCR3 Axis Induces Tumor-Associated Neutrophils to Interfere with CTLs-Mediated Antitumor Activity in EBV-Associated Epithelial Cancers”的研究论文。该研究发现,在EBV相关上皮癌中,中性粒细胞的浸润与含有颗粒酶B的细胞毒性T淋巴细胞(CTLs)的浸润呈负相关。
EBV相关上皮癌细胞中的CXCL10-CXCR3轴控制中性粒细胞胞外陷阱(NETs)的排出,从而干扰EBV抗原特异性T细胞在体内外的抗肿瘤活性。 NETs与EBV相关上皮癌中功能失调的CTLs数量呈正相关,并被证实是EBV相关上皮癌患者的独立预后因素。总而言之,这些发现揭示了EBV相关上皮癌中肿瘤相关中性粒细胞(TANs)免疫抑制的新机制。靶向TANs中的NETs形成可能是提高EBV相关上皮癌免疫治疗疗效的潜在策略。

EB病毒(EBV)是疱疹病毒科的一种,也是最常见的人类病毒之一,影响着全球90%以上的人口。虽然EBV通常与良性疾病有关,或者不会在大多数终身携带者中引起主要症状,但它也与一系列淋巴瘤的发展有关,例如伯基特淋巴瘤、经典霍奇金淋巴瘤和NK / T细胞淋巴瘤以及上皮恶性肿瘤。鼻咽癌(NPC)和EBV相关胃癌(EBVaGC)是最常见的EBV相关上皮癌,占所有EBV相关恶性肿瘤的80%。NPC是东南亚和北非部分地区最常见的EBV相关上皮癌之一。约95%的鼻咽癌病例为EBV阳性的非角化性鼻咽癌,而EBVaGC约占所有胃癌的10%。
具有丰富CD8+ T细胞的鼻咽癌和EBVaGC被称为“热”肿瘤。然而,在这些“热”肿瘤中也发现了耗竭的T细胞,导致肿瘤免疫逃逸。免疫疗法,包括免疫检查点抑制剂(ICIs)和过继细胞疗法(ACT),已成为克服肿瘤免疫逃逸机制的关键治疗方法。临床试验表明,ICIs在鼻咽癌和EBVaGC患者中未达到预期疗效。此外,ACT在临床试验中显示出对鼻咽癌患者的益处有限。这些现象表明EBV相关的上皮癌存在免疫抑制。
越来越多的研究致力于阐明EBV如何促进免疫抑制的维持。例如,据报道,EBV驱动的潜伏膜蛋白、细胞因子和microRNA可上调鼻咽癌和EBVaGC中的PD-L1表达。此外,肿瘤微环境(TME)中的免疫细胞在EBV相关上皮癌的免疫抑制调控中发挥着重要作用。EBV依赖的表观遗传修饰和鼻咽癌细胞的EBV激活,促进Treg细胞的增殖,从而形成免疫抑制微环境。鼻咽癌中的巨噬细胞通过EBV诱导的CSF-1和ATR极化为M2巨噬细胞,导致肿瘤进展。然而,EBV相关上皮癌中的TME是一个复杂而动态的生态系统,目前尚不完全清楚。
肿瘤微环境中的中性粒细胞,又被称为肿瘤相关中性粒细胞 (TANs),近年来受到越来越多的关注。据报道,TANs 发挥着一种矛盾的作用,既影响肿瘤进展,又影响肿瘤抑制。TANs 通过吞噬作用发挥作用;释放活性氧 (ROS)、颗粒和酶;或形成中性粒细胞胞外诱捕网 (NETs),这些诱捕网受肿瘤操纵,进而调节肿瘤微环境 (TME)。NETs 是一种网状结构,包含由中性粒细胞挤出的细胞外 DNA 纤维和相关颗粒蛋白。NETs 通过诱导细胞凋亡和抑制肿瘤细胞增殖或迁移发挥抗肿瘤作用,并通过促进转移、唤醒休眠癌细胞和保护癌细胞免受细胞毒性发挥促肿瘤作用。它们还可以通过抑制其他免疫细胞(例如 T 淋巴细胞)的活化和功能来创造免疫抑制环境。 NETs 的形成过程被称为 NETosis。NETosis 的典型机制是依赖于活性氧 (ROS) 的产生和肽基精氨酸脱亚胺酶 4 (PAD4)。PAD4 是一种 Ca2+ 特异性酶,主要位于细胞核内,它通过将精氨酸转化为瓜氨酸来修饰组蛋白,导致染色质解聚。当细胞核破裂时,瓜氨酸化的组蛋白会与核 DNA 一起被释放。该过程受多种因素诱导,例如慢性应激、组织蛋白酶 C 和趋化因子。
该研究探究了 EBV 相关的上皮癌细胞如何诱导 NETs 的形成,以及 NETs 如何影响杀伤细胞的细胞毒性,从而促进 EBV 相关的上皮癌的进展。了解这些机制可以促进开发新的治疗策略,旨在重新编程 NETs 或 TANs 以减轻其促肿瘤作用,从而提高免疫治疗的疗效,并为 EBV 相关上皮癌患者带来更好的临床结果。
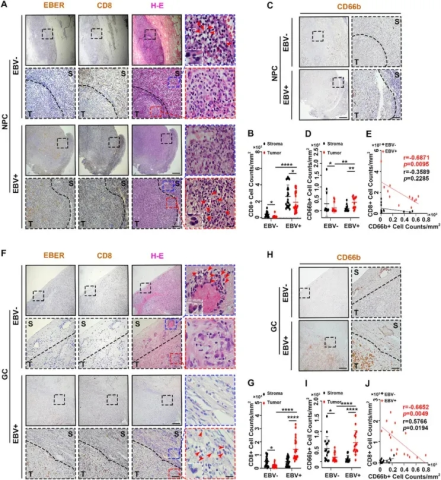
图1 EBV相关上皮癌中的TANs与CD8+ T细胞数量呈负相关(图源自Advanced Science)
(来源:iNature)
原文出处:Ouyang D, Xiang T, Chen Y, Song M, Zhao J, Chen H, Li S, Zhang L, Xu C, Ren Y, Tao Y, Wang Q, He J, Li Y, Xie S, Liu Y, Wang Y, Yang X, You J, Xie S, Li Y, Weng D, Pan Q, Yang Q, Xia J. The CXCL10-CXCR3 Axis Induces Tumor-Associated Neutrophils to Interfere with CTLs-Mediated Antitumor Activity in EBV-Associated Epithelial Cancers. Adv Sci (Weinh). 2025 Jul 21:e00950. doi: 10.1002/advs.202500950. Epub ahead of print. PMID: 40686457.
